
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Волновые функции водорода
|
|
|
|
Посмотрим же, что мы открыли. Состояния, которые удовлетворяют уравнению Шредингера для электрона в кулоновом поле, характеризуются тремя (причем целыми) квантовыми числами n, l, m. Угловое распределение амплитуды электрона может обладать только определенными формами, которые мы обозначим Yl,m. Они нумеруются числом l — квантовым числом полного момента количества движения я т — «магнитным» квантовым числом, которое может меняться от - l до + l. При каждой угловой конфигурации возможны различные радиальные распределения Fn,l (r) амплитуды электрона; они нумеруются главным квантовым числом n, которое может меняться от l +1 до ¥. Энергия состояния зависит только от n и растет с n. Состояние наинизшей энергии, или основное, является s -состоянием. У него l= 0, n =1 и m= 0. Это «невырожденное» состояние: имеется только одно состояние с такой энергией, а волновая функция у него сферически симметрична. Амплитуда того, что электрон обнаружится, достигает максимума в центре и монотонно спадает с удалением от центра. Эту электронную амплитуду можно изобразить этаким комочком (фиг. 17.6, а).
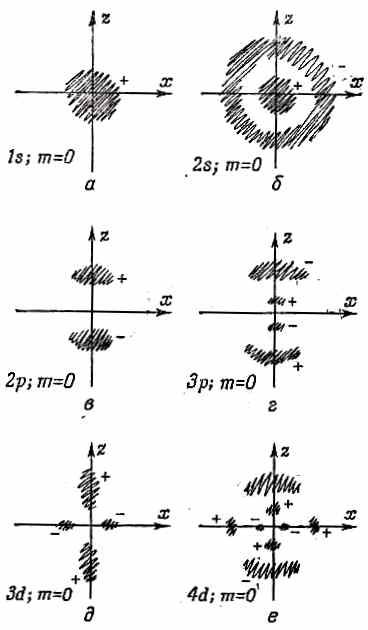
Фиг. 17.6. Наброски, отражающие общий характер волновых функций водорода.
В заштрихованных местах амплитуды велики. Знаки плюс и минус — это относительные знаки амплитуд в каждой области.
Имеются и другие s-состояния, с большими энергиями; у них n =2, 3, 4,... и l= 0. Каждой энергии соответствует только одно состояние m= 0, и все они сферически симметричны. Амплитуды этих состояний с ростом r один или несколько раз меняют знак. Имеется n- 1 сферических узловых поверхностей, или мест, где y проходит через нуль. Например, 2 s -состояние (l =0, n= 2 ) выглядит так, как показано на фиг. 17.6, б. (Темные области указывают те места, где амплитуда велика, а знаки плюс и минус отмечают относительные фазы амплитуды.) Уровни энергии s-состояний показаны в первом столбце фиг. 17.7.
|
|
|
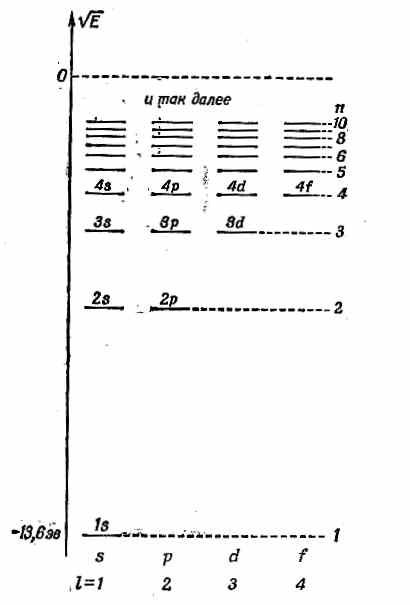
Фиг. 17.7. Диаграмма уровней энергии водорода.
Затем бывают р -состояния с l= 1. Для каждого n (n равно или больше 2) существует тройка состояний с одинаковой энергией, одно с m =+1, другое с m =0, третье с m=- 1. Уровни энергии отмечены на фиг. 17.7. Угловые зависимости этих состояний приведены в табл. 17.1. Так, при m= 0, если амплитуда положительна для углов q, близких к нулю, то при углах q, близких к 180°, она окажется отрицательной. Имеется узловая плоскость, совпадающая с плоскостью ху. При n >1 бывают также конические узловые поверхности. Амплитуда n =2, m =0 намечена на фиг. 17.6, в, а волновая функция n =3, m= 0 — на фиг. 17.6, г.
Могло бы показаться, что поскольку т дает, так сказать, «ориентацию» в пространстве, то должны наблюдаться еще такие же распределения, но с пиками вдоль оси х или вдоль оси у. Можно подумать, что это скорее всего состояния с m =+1 и с m =-1. Однако это не так! Но зато раз у нас есть тройка состояний с одинаковыми энергиями, то любая линейная комбинация из этой тройки тоже будет стационарным состоянием с той же энергией. Оказывается, что «x»-состояние (по аналогии с «z»-состоянием, или состоянием с m =0, см. фиг. 17.6, в) это линейная комбинация состояний с m =+1' и с m =-1. Другая комбинация дает «y»-состояние. Точнее, имеется в виду, что состояния
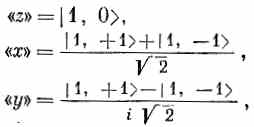
если отнести их к своим осям, выглядят одинаково.
У d-состояний (l =2) для каждой энергии есть пять возможных значений т; наинизшей энергией обладает n =3. Уровни показаны на фиг. 17.7. Угловые зависимости усложняются. К примеру, состояния с m =0 обладают двумя коническими узловыми поверхностями, так что при переходе от северного полюса к южному волновая функция меняет фазы с + на — и обратно на +. Примерная форма амплитуды нарисована на фиг. 17.6, д и е для состояний с m =0 и n =3 и 4. И снова при больших n появляются конические узловые поверхности.
|
|
|
Мы не будем пытаться описывать другие последующие состояния. Подробное изложение волновых функций водорода вы найдете во многих книгах. Рекомендую вам особенно; L. Pauling, E.B.Wilson, Introduction to Quantum Mechanics, New York, 1935; R. B. Leightоn. Principles of Modern Physics, New York, 1959. В этих книгах вы найдете графики некоторых функций и графическое изображение многих состояний.
Хотелось бы упомянуть об одном особом свойстве волновых функций при высших l: при l >0 амплитуды обращаются в центре в нуль. Ничего в этом удивительного нет, ведь электрону трудно иметь большой момент, когда плечо момента очень мало. По этой причине чем l большe, тем дальше амплитуды «отталкиваются» от центра. Если вы посмотрите, как радиальные функции F(r) меняются при малых r, то из (17.53) окажется, что
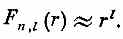
Такая зависимость от r означает, что при больших l вам придется дальше отойти от r =0, чтобы получить заметную амплитуду. Такое поведение, кстати, определяется членом с центробежной силой в радиальном уравнении, так что все это применимо к любому потенциалу, который при малых r меняется медленнее, чем 1/r2, а таково большинство атомных потенциалов.
§ 6. Периодическая таблица
Теперь мы хотели бы применить теорию атома водорода к объяснению химической периодической таблицы элементов. В атоме элемента с атомным номером Z имеется Z электронов, которые удерживаются электрическим притяжением ядра, но при этом взаимно отталкиваются друг от друга. Чтобы получить точное решение, пришлось бы решить уравнение Шредингера для Z электронов в кулоновом поле. Для гелия уравнение имеет вид
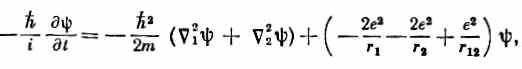
где Ñ21 — лапласиан, который действует на r1, координату первого электрона; Ñ22 действует на r2, a r 12 =|r 1 - r2|. (Мы опять пренебрегаем спинами электронов.) Чтобы найти стационарные состояния и уровни энергии, следовало бы отыскать решения вида
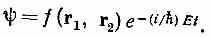
Геометрическая зависимость заключена в f — функции шести переменных — одновременных положений двух электронов. Аналитического решения никто не знает, хотя решения для низших энергетических состояний и были найдены численными методами.
Когда электронов 3, 4 или 5, безнадежно пытаться получить точные решения. Поэтому было бы опрометчиво утверждать, что квантовая механика до конца объяснила периодическую таблицу. Но все же можно сказать, что даже с помощью довольно сомнительных приближений (и кое-какой последующей отделки) удается, по крайней мере качественно, понять многие химические свойства, проявляющиеся в периодической таблице.
|
|
|
Химические свойства атомов определяются в первую очередь их низшими энергетическими состояниями. Для отыскания этих состояний и их энергий мы воспользуемся следующей приближенной теорией. Во-первых, пренебрежем спином электрона, разве только что принцип запрета будет принят нами во внимание и мы будем считать, что каждое частное электронное состояние может быть занято только одним электроном. Это означает, что на одной орбите не может оказаться больше двух электронов — один со спином, направленным вверх, другой — вниз. Затем мы в первом приближении пренебрежем деталями взаимодействия электронов и будем считать, что каждый электрон движется в центральном поле, образуемом полями ядра и всех прочих электронов. Про неон, у которого 10 электронов, мы скажем, например, что каждый электрон в атоме неона испытывает влияние среднего потенциала ядра и оставшейся девятки электронов. Мы вообразим далее, что в уравнение Шредингера для каждого электрона мы подставляем V (r) — то же поле 1/ r, но только видоизмененное за счет сферически симметричной плотности заряда, возникшей от остальных электронов.
В такой модели каждый электрон ведет себя как независимая частица. Угловые зависимости его волновой функции будут попросту такими же, какие были у атома водорода. Это будут те же s -состояния, р -состояния и т. п., и у них будут различные значения т. Раз V (r)больше не следует закону 1 /r, то радиальная часть волновых функций слегка перекраивается, но качественно останется прежней, так что по-прежнему будет существовать радиальное квантовое число п. Энергии состояний тоже станут немного иными.
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 532; Нарушение авторских прав?; Мы поможем в написании вашей работы!