
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вторичная структура белка
Вторичная структура белка – это пространственная структура, которая формируется в результате образования водородных связей между атомом кислорода карбонильной группы (СО) и атомом водорода аминогруппы (NH), входящими в состав пептидного остова.
Известны 3 основных типа вторичной структуры пептидных цепей: α-спираль, β-структура (складчатый слой) и беспорядочный клубок.
Образование 3 типов вторичной структуры зависит от характера первич- ной структуры, а именно, химических свойств боковых радикалов аминокислот, которые непосредственно не участвуют в образовании свя- зей, но определяют, каким образом пептидная цепь может свернуться и может ли свернуться вообще.
Одной из причин такого распределения, является то, что одноимен- ные радикалы, отталкиваясь, препятствуют образованию как α–спирали, так и β–структуры; не образуется α–спираль и β–структура на участках, содержащих остатки пролина и т.д.
В α-спирали NH-группа одного остатка аминокислоты соединяется водородной связью с СО-группой пятого от нее остатка (рис.13). В итоге образуется спираль, где на 1 виток приходится в среднем 3,6 аминокис- лотных остатков, шаг спирали равен 0,54мм, диаметр спирали - 0,5мм. Водородные связи ориентированы вдоль оси спирали (рис.14).
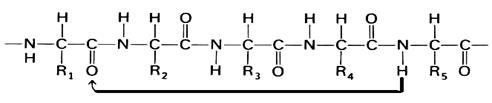

Рис.13. Принцип образования α-спирали: NH-группа 5-го остатка связана водородной связью с СО-группой 1 остатка (n-4)
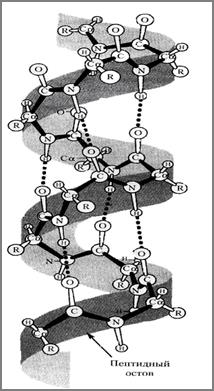
Рис. 14. α-спираль пептидной цепи.
В образовании α–спирали принимают участие почти все атомы водорода и кислоро- да пептидных групп; множество возникающих водородных связей стягивают линейный полимер в α-спираль, делая устойчивей конфигурацию пептидного остова. Так как, все гидрофильные группы пептидного остова участвуют в образовании водородных связей, гидрофильность (т.е., способность образовы- вать водородные связи с водой) α-спирали уменьшается, а гидрофобность увеличивается. Радикалы α-спирали расположены на ее наружной стороне и направлены в сторону от пептидного остова (рис.15).
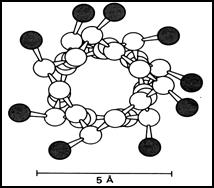 Рис.15. α-спираль в поперечном разрезе.
Рис.15. α-спираль в поперечном разрезе.
|
|
Дата добавления: 2015-06-04; Просмотров: 910; Нарушение авторских прав?; Мы поможем в написании вашей работы!