
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приготовление сахарного раствора
|
|
|
|
Рассчитываем массу сахарного раствора  заданной концентрации при приготовлении его из 100 кг сахара по пропорции, кг [1]:
заданной концентрации при приготовлении его из 100 кг сахара по пропорции, кг [1]:
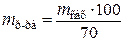 , (1.1)
, (1.1)
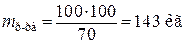 .
.
Определяем количество воды  , кг:
, кг:
 , (1.2)
, (1.2)
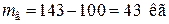 .
.
Определяем объём воды V, м3:

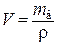 , (1.3)
, (1.3)
где  – плотность воды при заданной температуре, кг/м3 [6].
– плотность воды при заданной температуре, кг/м3 [6].
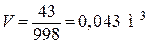 .
.
1.3 Определение объёма 10 % – ной соляной кислоты для проведения гидролиза
Для гидролиза 62,5 кг сахарного раствора рекомендовано взять 15 г HCl. Тогда для проведения гидролиза 143 кг сахарного раствора рассчитаем массу соляной кислоты, 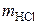 , г, по пропорции:
, г, по пропорции:
 , (1.4)
, (1.4)

Рассчитаем необходимое количество 10 %-го раствора соляной кислоты, необходимое для проведения гидролиза по формуле, г:
 , (1.5)
, (1.5)

Определим объём 10 %-го раствора соляной кислоты, л:
 , (1.6)
, (1.6)
где 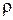 – плотность 10 %-го раствора соляной кислоты при 20 °С, кг/м3 [1].
– плотность 10 %-го раствора соляной кислоты при 20 °С, кг/м3 [1].
 = 0,33 л.
= 0,33 л.
1.4 Определение количества 10 %-го раствора бикарбоната натрия для нейтрализации соляной кислоты
Реакция нейтрализации:
HCl + NaHCO3 = NaCl + H2O + CO2
Для нейтрализации 35 г соляной кислоты, зная молекулярную массу, по пропорции определим необходимое количество бикарбоната натрия, г.
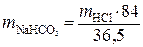 , (1.7)
, (1.7)

Тогда количество 10 %-го раствора бикарбоната натрия, г:
 , (1.8)
, (1.8)

Определим объём 10 %-го раствора бикарбоната натрия, л:
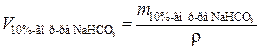 , (1.9)
, (1.9)
где 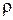 – плотность 10 %-го раствора бикарбоната натрия при 20 °С, кг/м3 [1].
– плотность 10 %-го раствора бикарбоната натрия при 20 °С, кг/м3 [1].
 .
.
Результаты материального расчёта сводятся в таблицы.
Таблица 1.1 – Приход по материальному балансу процесса получения инвертного сиропа
| Наименование сырья | Приход | |||
| Масса, G, кг | Плотность, r, кг/м3 | Объем, V, л | ||
| Вода | 1334** | 107,2 | ||
| Сахар | 1600, 900* | |||
| 10 %-й раствор соляной кислоты | 0,350 | 0,33 | ||
| 10 %-й раствор бикарбоната натрия | 0,81 | 0,75 | ||
| Итого | å144,16 | å108,3 | ||
| Примечание: * – насыпная плотность, кг/м3; **– плотность 70%-го раствора сахара при 50°С. |
|
|
|
Таблица 1.2 – Расход по материальному балансу процесса получения инвертного сиропа
| Наименование сырья | Расход | ||
| Масса, G, кг | Плотность, r, кг/м3 | Объем, V, л | |
| Инвертный сироп | 144,16 | 108,1 | |
| Итого | å144,16 | å108,1 |
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 884; Нарушение авторских прав?; Мы поможем в написании вашей работы!