
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титрования с индикатором салициловой кислотой
|
|
|
|
Лабораторная работа
Фотометрическое титрование с индикатором
Фотометрическое титрование с индикатором применяют тогда, когда титруемое вещество, титрант и продукт реакции не поглощают свет (бесцветны). Чаще всего при этом используют реакции комплексообразования.
В качестве индикатора могут быть применены вещества, не поглощающие свет заданной длины волны (ελ(Ind) = 0), но образующие хотя бы с одним из веществ титруемой системы соединение, поглощающее свет заданной длины волны (ελ (AInd)>0, или ελ (ВInd)>0 или ελ (AВInd)>0). Сущность титрования и кривые аналогичны рассмотренным в п.1.7.2 [3, c. 265-267].
Количественное определение Fe3+ методом фотометрического
Определение основано на том, что салициловая кислота с Fe3+ образуют комплексный ион – салицилат железа, интенсивно окрашенный с максимумом поглощения при λ = 525нм. Этот комплекс в кислой среде (рН = 2,4) менее устойчив, чем бесцветный комплекс с Na2-ЭДТА, поэтому можно провести количественное определение Fe3+, титруя фотометрически этот ион и его салицилат в кислой среде рабочим раствором Na2-ЭДТА до полного обесцвечивания, наблюдающегося в точке эквивалентности.
Схематически взаимодействие определяемого иона с индикатором можно представить так:

 Fe3+ + H2Sal [FeSal]+ + 2H+
Fe3+ + H2Sal [FeSal]+ + 2H+
В этой схеме символом Sal 2- обозначен анион салициловой кислоты
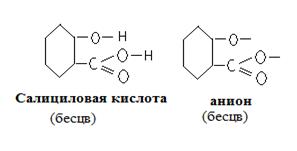
Комплексный ион [FeSal]+ имеет фиолетовую окраску в кислой среде (рН=2,4).
При титровании [FeSal]+ рабочим раствором Na2-ЭДТА происходит разрушение [FeSal]+ как менее прочного комплекса и образование бесцветного, но более прочного комплекса железа (III) с Na2 -ЭДТА, что можно представить схемой:
 [FeSal]+ + [H2Tr]2- [FeTr]+ + H2Sal
[FeSal]+ + [H2Tr]2- [FeTr]+ + H2Sal
фиолет бесцв бесцв бесцв
|
|
|
1 Задание. Определить количество вещества и массу Fe3+ в анализируемом растворе методом фотометрического титрования.
2 Приборы, посуда и реактивы:
1) прибор для фотометрического титрования;
2) мерная колба объемом 50,0 мл;
3) микробюретка объемом 2,0 мл;
4) пипетка объемом 1,0 или 2,0 мл;
5) рабочий титрованный раствор трилона Б, С(Na2-ЭДТА) = 0,01 моль/л;
6) анализируемый раствор Fe3+ - салицилат железа (III) [FeSаl]+.
3 Выполнение работы:
1) подготовить прибор к работе по инструкции к прибору;
2) приготовить анализируемый раствор. Для этого 1,0 мл раствора салицилата железа поместить в мерную колбу объемом 50,0 мл и довести до метки дистиллированной водой, перемешать;
3) перенести весь объем раствора из мерной колбы в кювету прибора с магнитной мешалкой на дне. Наружная поверхность кюветы должна быть сухой;
4) микробюретку заполнить рабочим раствором Na2-ЭДТА и направить носик бюретки в кювету с раствором. Включить мешалку;
5) титровать раствор [FeSаl]+ раствором Na2 - ЭДТА, приливая по 0,1 мл и ведя запись;
| Объём титранта, мл | 0,0 | 0,1 | 0,2 | 0,3 | и т.д. |
| Показания прибора |
6) титрование закончить, получив 5-6 одинаковых показаний прибора;
7) повторить титрование по п.п.2-6 еще раз;
8) по результатам двух титрований построить две кривые титрования в координатах «показания прибора - V (Na2-ЭДТА)» и определить по точкам эквивалентности два объема рабочего раствора Na2-ЭДТА, затраченного на взаимодействие с 1,0 мл раствора [FeSаl]+, вычислить средний;
9) для решения аналитической задачи получить у преподавателя в чистую мерную колбу объемом 50,0 мл неизвестный объем раствора [FeSаl]+ и выполнить работу по п.п. 2-6;
10) по результатам титрования построить кривую титрования и определить объем рабочего раствора Na2 - ЭДТА, затраченный на взаимодействие с неизвестным объемом [FeSаl]+;
11) сравнивая результаты п.8 и п.10 найти объем контрольного раствора, проверить его правильность и вычислить абсолютную и относительную ошибки определения;
|
|
|
12) по известной концентрации рабочего раствора Na2–ЭДТА (С(Na2-ЭДТА) = 0,01 моль/л) вычислить содержание в контрольном растворе массы и количества вещества Fe3+ [2, 7].
|
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 2001; Нарушение авторских прав?; Мы поможем в написании вашей работы!