
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Толыктыру керек 1 страница
3.Изопроцестер (осы процестегі теңдеуі, графигі, жұмысы)
Термодинамикалық процесс деп қарастырылатын термодинамикалық жүйенің параметрлерінің өзгеруімен сипатталатын жүйенің күйінің өзгеруін айтады.Берілген жағдайда атомдарының арасындағы өзара әсерлесу күші елеусіз аз болатын газды идеал газ деп атайды.Қалыпты жағдайдағы газдарды идеал газ деп есептеуге болады. Термодинамикалық параметрлер арасындағы байланысты анықтайтын теңдеуді күй теңдеуі деп атайды.
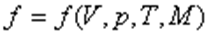 . 1. Изотермиялық процесс: Тұрақты температурада өтетін процесс изотермиялық процесс деп аталады.
. 1. Изотермиялық процесс: Тұрақты температурада өтетін процесс изотермиялық процесс деп аталады. 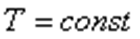 .Изотермиялық процесті сипаттайтын заңды ағылшын ғалымы Бойль мен француз ғалымы Мариот бір-бірінен тәуелсіз, тәжірибе жүзінде алды. Сондықтан бұл заң Бойль-Мариот заңы деп аталады.
.Изотермиялық процесті сипаттайтын заңды ағылшын ғалымы Бойль мен француз ғалымы Мариот бір-бірінен тәуелсіз, тәжірибе жүзінде алды. Сондықтан бұл заң Бойль-Мариот заңы деп аталады.
Берілген газдың массасы үшін тұрақты температурада газ қысымының көлемге көбейтіндісі тұрақты болады.
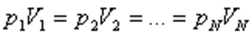 немесе
немесе 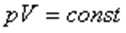
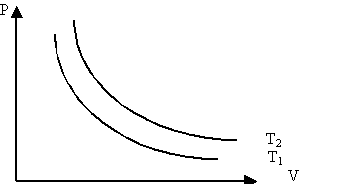
Изотермиялық процесті сипаттайтын графикті изотерма деп атайды. Графикте Т1<Т2.
2. Изобаралық процесс:
Тұрақты қысымда өтетін процесс изобаралық процесс деп аталады.
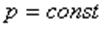 .Изобаралық процесті сипаттайтын заңды француз ғалымы Гей-Люссак тәжірибе жүзінде алды. Сондықтан бұл заң Гей-Люссак заңы деп аталады. Берілген газдың массасы үшін тұрақты қысымда газ көлемінің температураға қатынасы тұрақты болады.
.Изобаралық процесті сипаттайтын заңды француз ғалымы Гей-Люссак тәжірибе жүзінде алды. Сондықтан бұл заң Гей-Люссак заңы деп аталады. Берілген газдың массасы үшін тұрақты қысымда газ көлемінің температураға қатынасы тұрақты болады.
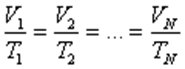 немесе
немесе 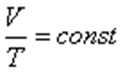 .
.
Гей-Люссак заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады: 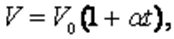
мұндағы: 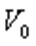 -
- 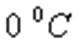 температурадағы газ көлемі,
температурадағы газ көлемі, 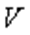 -
- 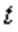 температурадағы газ көлемі,
температурадағы газ көлемі, 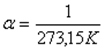 - газ көлемінің ұлғаюының температуралық коэффициенті.
- газ көлемінің ұлғаюының температуралық коэффициенті.
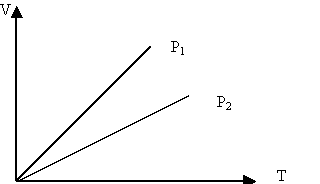
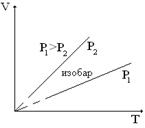
Изобаралық процесті сипаттайтын графикті изобара деп атайды. Графикте р1<р2.
3. Изохоралық процесс: Тұрақты көлемде өтетін процес изохоралық процесс деп аталады.
 .
.
Изохоралық процесті сипаттайтын заңды француз ғалымы Шарль тәжірибе жүзінде алды. Сондықтан бұл заң Шарль заңы деп аталады. Берілген газдың массасы үшін тұрақты көлемде газ қысымының температураға қатынасы тұрақты болады.
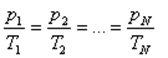 немесе
немесе 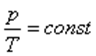 .
.
Шарль заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:
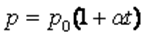 ,мұндағы:
,мұндағы: 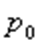 -
- 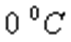 температурадағы газ қысымы,
температурадағы газ қысымы, 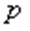 -
- 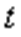 температурадағы газ қысымы,
температурадағы газ қысымы, 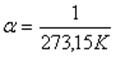 - газ қысымының температуралық коэффициенті.
- газ қысымының температуралық коэффициенті.
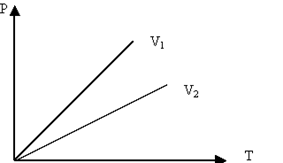
Изохоралық процесті сипаттайтын графикті изохора деп атайды. Графикте V1<V2.
4.Температура. Идеал газдың ішкі энергиясы. Еркіндік дәрежелеріне сәйкес энергияның бірқалыпты үлестірілу заңы.
Кез келген заттың ыстық немесе суық болуын сипаттайтын ерекше шаманы температура деп атайды.
Температура заттың жылылық қасиетін сипаттайтын шама
Термометрлік шаманың температураға тәуелділігін сандық түрде сипаттау үшін, температураның өлшем бірлігін енгізуіміз керек. Температураның өлшем бірлігі ретінде “градус” (латынның gradus – адым) тағайындалған.Екінші температураның және аралық-тағы кез келген температуралардың мәнін анықтауға болады. Сөйтіп, температуралық шкала құрылады
Идеал газдың молекуласының орташа энергиясы (2.5 бап) былай анықталады: 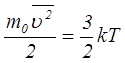 (2.47)мұндағы
(2.47)мұндағы 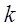 – Больцман тұрақтысы,
– Больцман тұрақтысы, 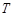 – газдың температурасы,
– газдың температурасы, 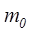 –молекула массасы,
–молекула массасы, 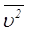 – молекуланың орташа квадраттық жылдамдығы.Бұл теңдеу молекулалары материялық нүктелер және олар тек ілгерілемелі қозғалыста деп есептелетін идеал біратомды газ үшін жазылған. Егер газдың молекулалары бірден көп атомдардан құралған болса, мұндай көпатомды молекула айналмалы және тербелмелі қозға-лыста болуы мүмкін, онда бұл қозғалыстармен байланысты энергияны ескеру қажет.
– молекуланың орташа квадраттық жылдамдығы.Бұл теңдеу молекулалары материялық нүктелер және олар тек ілгерілемелі қозғалыста деп есептелетін идеал біратомды газ үшін жазылған. Егер газдың молекулалары бірден көп атомдардан құралған болса, мұндай көпатомды молекула айналмалы және тербелмелі қозға-лыста болуы мүмкін, онда бұл қозғалыстармен байланысты энергияны ескеру қажет.
Біз алдымен біратомды газды қарастырамыз және оның белгілі массасындағы заттың барлық молекулаларының энергиясын анықтай-тын өрнекті табамыз. Егер газ 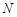 молекуладан құралса, онда олардың жалпы
молекуладан құралса, онда олардың жалпы 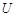 энергиясы мынаған тең болады:
энергиясы мынаған тең болады: 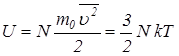 . (6.2)Бір моль газ үшін (6.2)-ші өрнектің түрі былай жазылады:
. (6.2)Бір моль газ үшін (6.2)-ші өрнектің түрі былай жазылады: 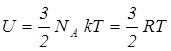 , (6.3)мұндағы
, (6.3)мұндағы 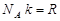 – универсал газ тұрақтысы,
– универсал газ тұрақтысы, 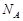 – Авогадро саны.Осы (6.3) өрнекпен анықталатын энергияны идеал газдың (бір молі үшін) ішкі энергиясы деп атайды.Жалпы жағдайда дененің ішкі энергиясы деп, оның құрамындағы молекулаларына қатысты “көзге көрінбейтін” энергиясын айтады. Сондықтан дененің немесе денелер жүйесінің ішкі энергиясы заттың құрамындағы барлық қозғалыстағы молекулаларының кинетикалық энергиясы, молекуланың атомдарының қозғалысының кинетикалық энергиясы (молекула көпатомды болса) мен ондағы молекулалардың өзара әрекеттесуінің потенциалдық энергиясы және атомның құрамы-на кіретін микробөлшектердің кинетикалық және потенциалдық энергиясы да ескерілуі мүмкін. Бірақ, бұған газдың тұтас дене ретіндегі қозғалысының кинетикалық энергиясы және сыртқы күштер өрісінде орналасқандағы потенциалдық энергиясы қосылмайды.Идеал газдың белгілі массасының ішкі энергиясы (6.2) және (6.3) өрнектер бойынша тек температураға тәуелді, газдың қысымы мен көлеміне тәуелді емес. Нақты газдар үшін бұл айтылғандар орындал-майды.Идеал газдың температурасын өзгерту үшін, оның ішкі энергиясын өзгерту керек екендігі, осы (6.2) және (6.3)-ші формуладан көрінеді. Ал механикадан белгілі, энергияның өзгеруі жұмыс істеумен байла-нысты: дененің энергиясы өзгереді, егер дене жұмыс істесе немесе дененің үстінен жұмыс істелсе, онда осы энергия өзгерісі істелген жұмысқа тең болады. Олай болса, газдың немесе кез келген дененің температурасының өзгеруі тек механикалық жұмыс істелгенде байқа-лады деп ойлауға болады. Мәселен, денені қыздыру үшін оның үсті-нен жұмыс істелуі қажет, ал суыту үшін дене өзі жұмыс істеуі керек.
– Авогадро саны.Осы (6.3) өрнекпен анықталатын энергияны идеал газдың (бір молі үшін) ішкі энергиясы деп атайды.Жалпы жағдайда дененің ішкі энергиясы деп, оның құрамындағы молекулаларына қатысты “көзге көрінбейтін” энергиясын айтады. Сондықтан дененің немесе денелер жүйесінің ішкі энергиясы заттың құрамындағы барлық қозғалыстағы молекулаларының кинетикалық энергиясы, молекуланың атомдарының қозғалысының кинетикалық энергиясы (молекула көпатомды болса) мен ондағы молекулалардың өзара әрекеттесуінің потенциалдық энергиясы және атомның құрамы-на кіретін микробөлшектердің кинетикалық және потенциалдық энергиясы да ескерілуі мүмкін. Бірақ, бұған газдың тұтас дене ретіндегі қозғалысының кинетикалық энергиясы және сыртқы күштер өрісінде орналасқандағы потенциалдық энергиясы қосылмайды.Идеал газдың белгілі массасының ішкі энергиясы (6.2) және (6.3) өрнектер бойынша тек температураға тәуелді, газдың қысымы мен көлеміне тәуелді емес. Нақты газдар үшін бұл айтылғандар орындал-майды.Идеал газдың температурасын өзгерту үшін, оның ішкі энергиясын өзгерту керек екендігі, осы (6.2) және (6.3)-ші формуладан көрінеді. Ал механикадан белгілі, энергияның өзгеруі жұмыс істеумен байла-нысты: дененің энергиясы өзгереді, егер дене жұмыс істесе немесе дененің үстінен жұмыс істелсе, онда осы энергия өзгерісі істелген жұмысқа тең болады. Олай болса, газдың немесе кез келген дененің температурасының өзгеруі тек механикалық жұмыс істелгенде байқа-лады деп ойлауға болады. Мәселен, денені қыздыру үшін оның үсті-нен жұмыс істелуі қажет, ал суыту үшін дене өзі жұмыс істеуі керек.
Бөлшектің кинетикалық энергиясының үш тәуелсіз құраушыға бөлінуі, оның үш еркіндік дәрежеге ие материялық нүкте ретінде қарастырылуымен байланысты. Механикалық жүйенің еркіндік дәрежелер саны деп, оның кеңістіктегі орнын және конфигурациясын анықтайтын тәуелсіз координаттар санын айтады. Сондықтан, біратомды молекуланың еркіндік дәрежелер саны үшке тең, онда әр еркіндік дәрежесіне 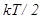 -ге тең энергия сәйкес келеді.
-ге тең энергия сәйкес келеді.
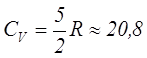 Дж/моль∙К,
Дж/моль∙К,
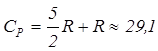 Дж/моль·К,
Дж/моль·К,
сондықтан 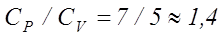 .
.
Молекулалары үшатомды немесе одан көпатомды газдар үшін мольдік жылу сыйымдылықтарының мәндері мынадай:
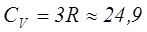 Дж/моль·К,
Дж/моль·К,
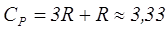 Дж/моль·К,
Дж/моль·К,
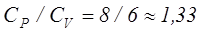 Дж/моль·К.
Дж/моль·К.
5.Жылусиымдылық. Жылусиымдылықтардың өзара байланыс қатынастары мен идеал газдардағы еркіндік дәрежелерімен санымен сипатталынуы. Кванттық жылусиымдылық туралы түсінік.
Газды қыздыруға жұмсалатын жылу мөлшері қыздырылатын заттың мөлшеріне және оның температурасын қанша градусқа өзгертуіне байланысты. Денені суыту үшін, одан бір шама жылу мөлшері алынады. Сондықтан, газдың немесе кез келген дененің жылулық қасиеттерін сипаттау үшін жылусыйымдылық деген шаманы қолданады.Дененің температурасын(1 К) өзгерту үшін, оған берілетін немесе одан алынатын жылу мөлшерін – жылусыйымдылы қ деп атайды. Жылусыйымдылық – меншікті және мольдік жылусыйымдылық деп бөлінеді.Заттың бірлік массасына қатысты жылусыйымдылықты – меншікті жылусыйымдылық деп атайды. Ол с кіші әрпімен белгіленеді. Бұл жылусыйымдылық дененің құрамындағы затты сипаттайды. Заттың бір моліне қатысты жылусыйымдылықты – мольдік жылусыйымдылық дейді. Ол С бас әрпімен белгіленеді. Жылусыйымдылықтың анықтамасы бойынша оның өлшем бірлігі Дж/К, ал меншікті жылусыйымдылықтың – Дж/К*кг және мольдік жылусыйымдылықтың өлшем бірлігі–Дж/К*кг болады.Меншікті жылусыйымдылық пен мольдік жылусыйымдылықтың арасындағы қатынас былай анықталады:с=С/М немесе 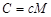 ,мұндағы М –мольдік масса.Жылусыйымдылық мына қатынасқа тең болады:
,мұндағы М –мольдік масса.Жылусыйымдылық мына қатынасқа тең болады: 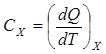 ,мұндағы
,мұндағы 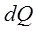 –денеге берілген (алынған) жылу мөлшері,
–денеге берілген (алынған) жылу мөлшері, 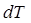 –темпе-ратураның өзгерісі,
–темпе-ратураның өзгерісі, 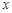 –көрсеткіш (индекс) өтетін процестің белгісі. Дененің температурасын
–көрсеткіш (индекс) өтетін процестің белгісі. Дененің температурасын 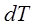 шамаға өзгертуге жұмсалатын
шамаға өзгертуге жұмсалатын 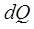 жылу мөлшері процеске тәуелді болғандықтан, жылусыйымдылығы да оны қыздыру немесе суыту шарттарына тәуелділікті көрсетеді, демек
жылу мөлшері процеске тәуелді болғандықтан, жылусыйымдылығы да оны қыздыру немесе суыту шарттарына тәуелділікті көрсетеді, демек 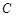 әр түрлі
әр түрлі 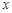 процестерде бірдей емес. Олай болса, әр түрлі процестерге байланысты жүйе әр түрлі мәндегі жылусыйымдылықпен сипатталады.
процестерде бірдей емес. Олай болса, әр түрлі процестерге байланысты жүйе әр түрлі мәндегі жылусыйымдылықпен сипатталады.
6.Молекулалар жылдамдығының Максвелл үлестірімі. Молекулалық шоқтармен тәжірибе жасау арқылы Максвелл үлестірімін дәлелдеу.
Осы 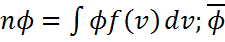 =
= 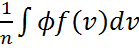 өрнектегі үлестірілу функциясының орнына
өрнектегі үлестірілу функциясының орнына 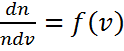 =
= 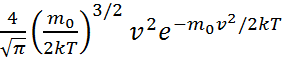 анықтайтын шамасын қойып,
анықтайтын шамасын қойып, 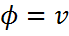 деп, оны 0 және ¥ аралығындағы мүмкін болатын жылдамдықтар бойынша интегралдап, орташа арифметикалық жылдамдықтың <v> мәнін табамыз: <v>=
деп, оны 0 және ¥ аралығындағы мүмкін болатын жылдамдықтар бойынша интегралдап, орташа арифметикалық жылдамдықтың <v> мәнін табамыз: <v>= 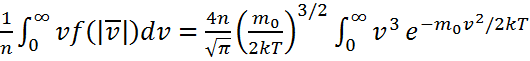 dv,мұндағы,
dv,мұндағы, 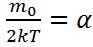 ал
ал 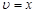 деп белгілесек, онда
деп белгілесек, онда 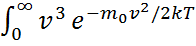 dv=
dv= 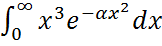 түріне келтіріледі. Мұндай интегралдардың мәнін келесі есептеу ережелерін қолданып, табамыз:
түріне келтіріледі. Мұндай интегралдардың мәнін келесі есептеу ережелерін қолданып, табамыз:
а) егер 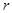 - жұп сан болса, онда
- жұп сан болса, онда 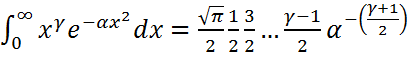 ;
;
б) егер 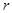 – тақ сан болса, онда
– тақ сан болса, онда 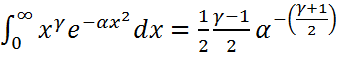 ;
;
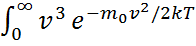 dv=
dv= 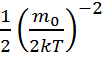 , <v> =
, <v> = 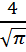
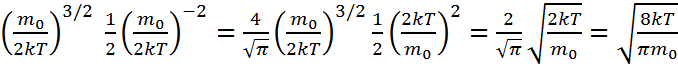
демек <v>= 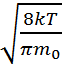 н\е <v>=
н\е <v>= 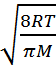 .мұндағыM– мольдік масса,
.мұндағыM– мольдік масса, 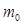 – молекула массасы,N– Авогадро саны, Т – температура, R – универсал газ тұрақтысы.
– молекула массасы,N– Авогадро саны, Т – температура, R – универсал газ тұрақтысы.
<v>= 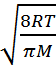 молекуланың орташа арифметикалық жылда-дығын анықтайды.Газдың белгілі массасындағы молекулалардың орташа арифметикалық жылдамдығы тек температураға тәуелді.
молекуланың орташа арифметикалық жылда-дығын анықтайды.Газдың белгілі массасындағы молекулалардың орташа арифметикалық жылдамдығы тек температураға тәуелді.
Молекулалардың орт кв жылд былай анықтаймыз: Максвеллдік күйдегі газ үшін молекулалық жылд-ң кез келген ф(v) функ-ң орт мәнін былай анықтаймыз:
nф= 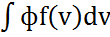
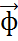 =
= 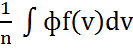
< 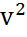 >=
>= 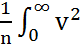 f(v)dv=
f(v)dv= 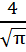 (
(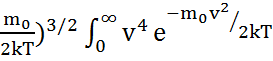 dv мұндағы
dv мұндағы
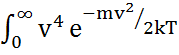 dv =
dv = 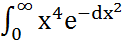 dx=
dx= 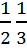
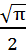 (
(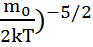 dv
dv
Сондықтан молекулалардың орт кв-қ жылд мынаған тең болады:
< 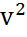 >=
>= 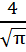 (
(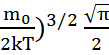
 (
(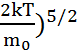 =
=  (
(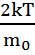 )=
)= 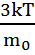 демек,
демек,
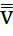 =<
=< 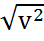 >=
>= 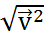 =
= 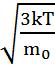
Бұл жылдамдық орт арифметикалық жыл-пен тең болмайды, шынында
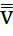 =
= 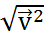 =
= 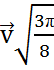 =1.086
=1.086 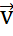
7.Барометрлік формула. Больцман үлестірімі. Максвелл-Больцман үлестірімі Молярлық, меншікті жылусиымдылықтар. Майер формуласы.
Молекулалардың хаосты қозғалысы газдың микробөлшектердің ыдыстың көлемі бойынша біркелкі таралуына және бірлік көлемде, орташалап алғанда, молекулалар саны бірдей болуына әкеледі. Тепе теңдік күйде газдың қысымы мен температурасы барлық көлемде бірдей болады.
 Атмосферадағы молекулалардың биіктік бойынша үлестірілуі белгілі заңға бағынады. Бұл үлестіру былай анықталады. Жер беті х=0,сондағы ауа қысымы
Атмосферадағы молекулалардың биіктік бойынша үлестірілуі белгілі заңға бағынады. Бұл үлестіру былай анықталады. Жер беті х=0,сондағы ауа қысымы 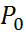 дейік,ал х биіктіктегі қысым P-ға тең дейік. Биіктік dx-қа өзгергенде қысым dp-ға өзгереді. Ауаның кез келген биіктіктегі қысымы p+dp, осы ауаның вертикаль бағанасының бірлік ауданға түсірген салмағына тең. Сондықтан (p+dp)s+mg=ps. Онда кез келген биіктіктегі dp қысым өзгерісі былай табылады;
дейік,ал х биіктіктегі қысым P-ға тең дейік. Биіктік dx-қа өзгергенде қысым dp-ға өзгереді. Ауаның кез келген биіктіктегі қысымы p+dp, осы ауаның вертикаль бағанасының бірлік ауданға түсірген салмағына тең. Сондықтан (p+dp)s+mg=ps. Онда кез келген биіктіктегі dp қысым өзгерісі былай табылады;
Sdp+mg=Sdp+ρVg=0 немесе dp= - ρgdx (1)
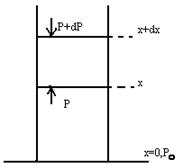 Мұндағы v-ауаның dx вертикаль баңанасының көлемі, V=Sdx; ρ-ауа тығыздығы, g-ауырлық күшінің үдеуі.
Мұндағы v-ауаның dx вертикаль баңанасының көлемі, V=Sdx; ρ-ауа тығыздығы, g-ауырлық күшінің үдеуі.
Ρ=  n; p=nkT→n=
n; p=nkT→n= 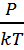 (2)
(2)
Ρ= 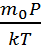 (3)
(3)
T-ауа темп-ы, k-больцман тұрақт.(3) ескеріп, (2) былай жазамыз. dp= - 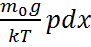 →
→ 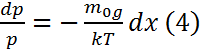 Барлық биіктік б/ша T=const болса,
Барлық биіктік б/ша T=const болса, 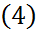 нтегралдап, қысымды х биіктік-ң функциясы түрінде анық-з:
нтегралдап, қысымды х биіктік-ң функциясы түрінде анық-з: 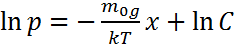 н/е потенциал қысым табамыз:
н/е потенциал қысым табамыз:
P=C 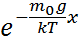 ; (5) С-интегралдау тұрақтысы,
; (5) С-интегралдау тұрақтысы, 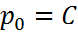
Изотермдік жағдайда ауаның қысымының Жердің бетінен биіктікке тәуелділігінің түрі былай өрнектеледі:
P= 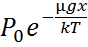 (6)
(6)
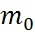 =
= 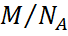 ескерсек, P=
ескерсек, P= 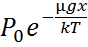 (7)
(7)
M ауаның мольдік массасы, R-универсал газ тұрақтысы (6) және (7) барометрлік формула.
Барометрлік формула ауырлық өрісінде атмосф-қ қысымның биіктік б/ша төмендеу заңын тағайындайдайды.
Идеал газ үшін Майердің қатынасы:
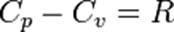 ,
,
Мұндағы, R – универсал газ тұрақтысы, 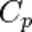 - тұрақты қысымдағы молярлық жылусыйымдылық,
- тұрақты қысымдағы молярлық жылусыйымдылық, 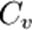 - тұрақты көлемдегі молярлық жылусыйымдылық. Майер теңдеуі идеал газдағы изобаралық процеске қолданылған термодинамиканың бірінші бастамасынан шығады.
- тұрақты көлемдегі молярлық жылусыйымдылық. Майер теңдеуі идеал газдағы изобаралық процеске қолданылған термодинамиканың бірінші бастамасынан шығады. 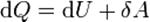 Қарастырылып отырған жағдайда:
Қарастырылып отырған жағдайда: 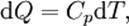 .
.
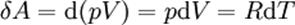 Майер теңдеуінен көріп отырғанымыздай, жылусыйымдылықтардың айырмасы жұмысқа тең, бұл температурасын 1К-ге өзгерткен кездегі идеал газдың бір молімен жізеге асады және
Майер теңдеуінен көріп отырғанымыздай, жылусыйымдылықтардың айырмасы жұмысқа тең, бұл температурасын 1К-ге өзгерткен кездегі идеал газдың бір молімен жізеге асады және 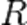 универсал газ тұрақтысының мағынасын анықтайды, ол – жылудың механикалық эквиваленті.
универсал газ тұрақтысының мағынасын анықтайды, ол – жылудың механикалық эквиваленті.
8.Термодинамиканың негізгі заңдары.
Термодинамика заңдылықтары жалпы сипатта қолданылады және заттардың атомдық деңгейдегі құрылымына тәуелді емес. Сондықтан термодинамика ғылым мен техниканың энергетика, қозғалтқыштар, фазалық ауысу, химиялық реакциялар, секілді көптеген салаларында қолданылады.Термодинамиканың физика мен химияның бірқатар салаларында, химиялық технология, аэроғарыштық технология, машина жасау, жасушалық биология, биомедициналық инженерия секілді алуан түрлі салаларда алатын орны ерекше. Термодинамиканың бірінші бастамасы — термодинамикалық жүйелер үшін керек энергияның сақталу заңы; бұл заң бойынша жүйеге берілетін жылу оның ішкі энергиясын өзгертуге және жүйенің сыртқы күштерге қарсы жұмысына жұмсалады.[1] Дене күйінің барлық энергиясы - микроскопиялық қозғалысының толық түріндегі сыртқы кинетикалық энергиясы Ек және салмақ күші өрісі, электрлі немесе магнит өрісі жағдайындағы потенциалды энергия Еn, сонымен қатар, дене бөлшектерінің құрамдық әрекеттері мен қозғалу энергиясын жасаушы ішкі энергия U қосындыларынан тұрады: 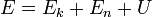 Қаралып отырған жылу динамикалық жүйе шамаланса, онда дененің орталық салмақтық алмасу жылдамдығы өте аз (С=0), яғни қозғалыссыз жұмыстық дене көлемінің өзгеруі туралы сөз болады, сондықтан Ек=0. Айталық, Ер=0 сонымен, бұл жерде толық энергия ішкімен бірдей (E=U), ал жүйе энергиясының өзгеруі - жұмыстық дененің, ішкі энергиясының өзгеруіне келтіреді.
Қаралып отырған жылу динамикалық жүйе шамаланса, онда дененің орталық салмақтық алмасу жылдамдығы өте аз (С=0), яғни қозғалыссыз жұмыстық дене көлемінің өзгеруі туралы сөз болады, сондықтан Ек=0. Айталық, Ер=0 сонымен, бұл жерде толық энергия ішкімен бірдей (E=U), ал жүйе энергиясының өзгеруі - жұмыстық дененің, ішкі энергиясының өзгеруіне келтіреді.
Жылу динамикасының бірінші заңына сәйкес, жұмыстық дененің энергиясы кезінде, қабылданған жағдайға тиісті кезіндегі жүйенің өтуі 1 бастапқы күйінен 2 соңғы мәндеріне артуы, денеге берілген жылулық dQ және мәніне келуі dL істелінген жүйе жұмысына тең: dU=dQ-dL немесе әдетте былай жазу қабылданған -
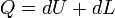
Сыртқы ортамен әрекеттестігі жоқ болғандағы кезінде (dQ=0 және dL=0), формуладағы dU=0, яғни жүйе энергиясы өзгеріссіз сақталады. Жүйелер қатнасының жекеленген жылулығы үшін, ондағы dQ=0 екені белгілі.
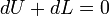
Теңдеу жұмыстық дененің еркінше алынған санды массасы m арналып жазылған, ал меншікті мәндері үшін былай жазылады:
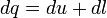 мұндағы q - меншікті жылулық саны; l - меншікті жұмыс; u - меншікті ішкі энергия, q, u, l бірлік өлшемі Дж/кг. Бұл теңдеу үшін, жылудинамикасының бірінші заңының талдаушы тұжырымдалуын көрсетеді, осыған сәйкес жүйеге жеткізілген жылу, жүйелердің ішкі энергиясына жұмсалады және жұмыстың атқарылуына қарсы денеге түскен сыртқы күш. Олар, қайтымдыға да және сыртқы қайтымсыз процесстер үшін де әділетті. Себебі, қабылданған жағдайдағы жылу алмасуы кезінде, дене мен орта арасының соңғы температура айырмашылығы кезінде, қайтымсыз жылуалмасуына сәйкес келеді. Термодинамиканың екінші бастамасы) — статистикалық нысандардың (мысалы, атомбеидардың, молекулалардың) үлкен санынан тұратын жүйелердің өз бетінше ықтималдығы аздау күйден ықтималдығы молырақ күйге ауысу процесін сипаттайтын табиғаттың түбегейлі заңы. Термодинамиканың екінші заңы табиғаттағы процестердің жүру бағытын көрсетеді.Өзін қоршаған кеңістікте ешқандай қалдық өзгерістер болмайтындай түрде жүретін термодинамикалық процесті қайтымды процесс деп атайды. Қайтымды процесс кезінде термодинамикалық жүйе бастапқы күйіне қайта келеді.Сыртқы ортада өзгерістер қалатындай түрде жүретін процесті қайтымсыз процесс деп атайды. Қайтымсыз процесс кезінде жүйе бұрынғы күйіне қайтып келмейді. Үйкеліс, кедергі күштерімен жүретін процестер қайтымсыз процесс болып табылады. Жылу алмасу кезінде жүретін процесс қайтымсыз процесс болып табылады. Тұйық жүйеде кез келген қайтымсыз процесс жүйенің энтропиясы өсетіндей жүреді (энтропияның өсу заңы). Термодинамиканың бірінші бастамасы термодинамикалық процестерге энергияның сақталу, айналу заңдарының қолдануға сай етіп береді. Термодинамиканы 2-ші бастамасы қандай процестер табиғата мүмкін, қандайы процестер мүмкін емес екендігін көрсете отырып термодинамикалық процестердің өту бағытын анықтайды.Термодинамиканың екінші бастамасының энтропияның өсуі заңына баламалы тағыда екі формулировкасы бар.
мұндағы q - меншікті жылулық саны; l - меншікті жұмыс; u - меншікті ішкі энергия, q, u, l бірлік өлшемі Дж/кг. Бұл теңдеу үшін, жылудинамикасының бірінші заңының талдаушы тұжырымдалуын көрсетеді, осыған сәйкес жүйеге жеткізілген жылу, жүйелердің ішкі энергиясына жұмсалады және жұмыстың атқарылуына қарсы денеге түскен сыртқы күш. Олар, қайтымдыға да және сыртқы қайтымсыз процесстер үшін де әділетті. Себебі, қабылданған жағдайдағы жылу алмасуы кезінде, дене мен орта арасының соңғы температура айырмашылығы кезінде, қайтымсыз жылуалмасуына сәйкес келеді. Термодинамиканың екінші бастамасы) — статистикалық нысандардың (мысалы, атомбеидардың, молекулалардың) үлкен санынан тұратын жүйелердің өз бетінше ықтималдығы аздау күйден ықтималдығы молырақ күйге ауысу процесін сипаттайтын табиғаттың түбегейлі заңы. Термодинамиканың екінші заңы табиғаттағы процестердің жүру бағытын көрсетеді.Өзін қоршаған кеңістікте ешқандай қалдық өзгерістер болмайтындай түрде жүретін термодинамикалық процесті қайтымды процесс деп атайды. Қайтымды процесс кезінде термодинамикалық жүйе бастапқы күйіне қайта келеді.Сыртқы ортада өзгерістер қалатындай түрде жүретін процесті қайтымсыз процесс деп атайды. Қайтымсыз процесс кезінде жүйе бұрынғы күйіне қайтып келмейді. Үйкеліс, кедергі күштерімен жүретін процестер қайтымсыз процесс болып табылады. Жылу алмасу кезінде жүретін процесс қайтымсыз процесс болып табылады. Тұйық жүйеде кез келген қайтымсыз процесс жүйенің энтропиясы өсетіндей жүреді (энтропияның өсу заңы). Термодинамиканың бірінші бастамасы термодинамикалық процестерге энергияның сақталу, айналу заңдарының қолдануға сай етіп береді. Термодинамиканы 2-ші бастамасы қандай процестер табиғата мүмкін, қандайы процестер мүмкін емес екендігін көрсете отырып термодинамикалық процестердің өту бағытын анықтайды.Термодинамиканың екінші бастамасының энтропияның өсуі заңына баламалы тағыда екі формулировкасы бар.
|
|
Дата добавления: 2015-06-04; Просмотров: 1797; Нарушение авторских прав?; Мы поможем в написании вашей работы!