
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые титрования по методу окисления - восстановления
|
|
|
|
Классификация методов окислительно-восстановительного титрования
Лекция 11. методы окислительно-восстановительного титрования
1. Классификация методов окислительно-восстановительного титрования
2. Кривые титрования по методу окисления — восстановления
3. Индикаторы, применяемые в редоксиметрии
4. Скорость реакций окисления - восстановления
Данная группа методов основана на окислительно-восстановительных реакциях, которые протекают между рабочим раствором и определяемым веществом. К этой группе относятся:
а) перманганатометрия — рабочий раствор КМnO4 - окислитель, при помощи которого определяют ионы Fe2+, NO2-, CNS- и др.;
б) иодометрия, где в качестве окислителя используют I2, а в виде восстановителя I-. Этим способом определяют КМnO4, MnO2, Cl2, Na2SO3 и др.;
в) хроматометрия - в качестве окислителя применяют рабочий раствор бихромата калия K2Cr2O7;
г) броматометрия — используют в качестве рабочего раствора окислитель — бромат калия КВrО3;
д) ванадатометрия — рабочим раствором служит раствор ванадата аммония NH4VO3;
е) цериметрия - окислителем и рабочим раствором являются различные соединения церия Се (IV).
При редоксиметрическом титровании изменяются концентрации участвующих в реакции веществ или ионов, а, следовательно, и окислительно-восстановительный потенциал раствора (Е). Если величины окислительно-восстановительных потенциалов, соответствующие различным моментам титрования, наносить на график, то получаются кривые титрования, аналогичные кривым, получаемым по методу кислотно-основного титрования.
В качестве примера рассчитаем и построим кривую титрования соли железа (II) перманганатом в кислой среде. Ионное уравнение этой реакции таково:
|
|
|

В любой из моментов титрований раствор всегда содержит две окислительно-восстановительные пары: Fe3+/Fe2+ и МпО4-/Мп2+. Следовательно, для вычисления величин Е имеются два уравнения:

| (11.1) (11.2) |
Пока оттитровано еще не все железо (II), концентрации Fe3+ и Fe2+ для любого момента титрования вычислить очень легко. Концентрации оставшихся, не вошедших в реакцию МпО4--ионов, вычислить гораздо труднее, так как приходится использовать константу равновесия данной окислительно-восстановительной реакции, которая должна быть известна, и учитывать концентрации ионов в каждый момент титрования. Поэтому удобнее пользоваться уравнением (11.1). Наоборот, при введении избытка перманганата легко вычисляются концентрации МпО4- и Мп2+ в растворе и гораздо труднее - концентрация оставшихся, не вошедших в реакцию Fe2+-ионов; поэтому для вычисления Е следует применять уравнение (11.2).
Рассчитывая первую точку на кривой титрования до прибавления перманганата в раствор, нужно учитывать, что в растворе не могут присутствовать только Fe2+-ионы, а всегда в ничтожно малой концентрации присутствуют и Fe3+-ионы. Поэтому для расчета первой точки на кривой титрования можно взять любое малое отношение [Fe3+]/[Fe2+], например 1/10000, 1/1000 и т. п.
Вычислим потенциал раствора для момента, когда к 100 мл раствора FeSO4 прибавлено 50 мл раствора КМпO4 данной нормальности. Очевидно, в рассматриваемый момент только 50% Fe2+-ионов, находившихся в 100 мл взятого раствора, перешло в Fe3+. Поэтому можно написать:

Особенный интерес представляют те точки на кривой титрования, которые соответствуют 0,1 мл недостатка и 0,1 мл избытка КМпО4, так как они определяют собой величину скачка потенциала около точки эквивалентности. Вычислим первую из этих точек (начало скачка). Поскольку в этот момент прилито 99,9 мл КМпО4, т. е. на 0,1 мл меньше, чем требуется по уравнению реакции, в растворе осталось неоттитрованным железо (II) в объеме 0,1 мл и оттитровано все остальное количество Fe2+, находившееся в объеме 99,9 мл первоначального раствора. Следовательно, для этого момента:
|
|
|
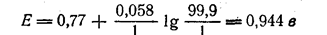
Найдем теперь величину Е в конце скачка, т. е. при введении 100,1 мл раствора перманганата. Из этого количества 100 мл затрачено на реакцию с Fe2+, т. е. МпО4- восстановлен до Мп2+. В виде МпО4- осталось то количество перманганата, которое содержалось в избытке (0,1мл) раствора. Следовательно, отношение [МпО4-]/[Мп2+] в этот момент равно 0,1:100 и

Если принять, что концентрация Н+-ионов растворе равна 1 г-ион/л, то получим:

Следовательно, скачок потенциала, обнаруживаемый в этих пределах титрования, будет равен 1,475—0,944=0,531 в.
Вычислим величину Е в точке эквивалентности. Для этого в приведенных выше выражениях (11.1) и (11.2) уравняем коэффициенты при членах, содержащих логарифмы [путем умножения уравнения (11.2) на 5]. После этого оба уравнения почленно сложим
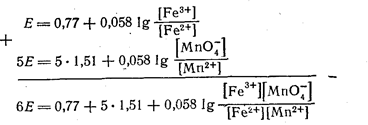
| (11.3) |
Так как в точке эквивалентности МпО4-- ионы вводятся в раствор в количестве, соответствующем уравнению реакции, то и при равновесии на каждый оставшийся в растворе МпО4--ион должно приходиться 5 Fe2+-ионов.
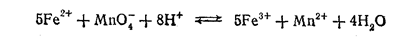
Следовательно, в точке эквивалентности концентрации Fe2+- в пять раз больше концентрации МпО4-, т. е.[Fe2+]=5[МпО4-]. В то же время: [Fe3+]= 5[Мп2+].
Поделив второе из этих равенств на первое, получим:

А так как lg 1 = 0, из уравнения (11.3) следует:
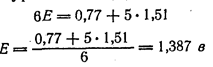
 В общем виде, если стандартные потенциалы пар, соответствующие взятым окислителю и восстановителю, равны Е0ок и Е0вос, а стехиометрические коэффициенты при них - а и в, тоокислительно-восстановительный потенциал раствора в точке эквивалентности равен:
В общем виде, если стандартные потенциалы пар, соответствующие взятым окислителю и восстановителю, равны Е0ок и Е0вос, а стехиометрические коэффициенты при них - а и в, тоокислительно-восстановительный потенциал раствора в точке эквивалентности равен:
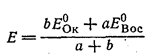
Рис. 11.1 Кривая титрования раствора
FeSO4 перманганатом (при [Н+]=1)
Кривая редоксиметрического титрования (рис.11.1) имеет такой же вид, как и кривые титрования по методам, основанным на реакциях соединения ионов. Вблизи точки эквивалентности здесь тоже наблюдается резкий скачок потенциалов. Наоборот, другие участки кривой идут полого, т. е. величина Е изменяется при титровании очень медленно. Наличием скачка на кривой титрования можно воспользоваться для точного фиксирования точки эквивалентности с помощью индикаторов.
|
|
|
В то же время кривые редоксиметрического титрования обычно не зависят от разбавления раствора, поскольку в уравнение Нернста входит отношение концентраций окисленной и восстановленной форм, которое с разбавлением раствора не изменяется. Кроме того, область скачка на кривой редоксиметрического титрования можно значительно расширить, если один из образующихся при реакции ионов связывать в комплекс, чем иногда успешно пользуются на практике.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 3076; Нарушение авторских прав?; Мы поможем в написании вашей работы!