
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И водородом
|
|
|
|
ВОССТАНОВЛЕНИЕ ОКСИДОВ ЖЕЛЕЗА ОКСИДОМ УГЛЕРОДА
Восстановление оксидов железа, в соответствии со схемой А.А. Байкова, происходит последовательно, от высшего к низшему и металлу. При температурах выше 570 °С (843 К) в превращениях участвуют все оксиды железа, процесс идет по схеме  , при температуре ниже 843 К – по схеме
, при температуре ниже 843 К – по схеме  .
.
Химические реакции восстановления оксидов железа оксидом углерода имеют вид (при Т >843 К):
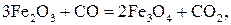
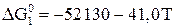 ; (15)
; (15)

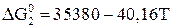 ; (16)
; (16)

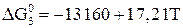 . (17)
. (17)
При Т < 843 К происходит непосредственное восстановление  до железа по реакции
до железа по реакции
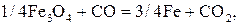
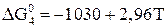 . (18)
. (18)
Константы равновесия этих реакций выражают отношением равновесных парциальных давлений  и
и 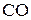
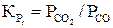 (19)
(19)
и вычисляют по уравнениям
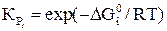 . (20)
. (20)
Реакции восстановления оксидом железа водородом и их термодинамические функции имеют вид:

 ; (21)
; (21)

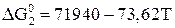 ; (22)
; (22)

 . (23)
. (23)
При температуре ниже 843 К 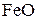 не образуется, но протекает реакция
не образуется, но протекает реакция
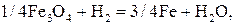
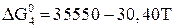 . (24)
. (24)
Константы равновесия для реакций (21–24) имеют вид
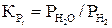
и вычисляют по уравнениям
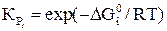 .
.
В соответствии с правилом фаз для трех компонентов и трех фаз (две твердые, одна газовая фаза) С=К+2–Ф=3+2–3=2, то есть для определения равновесного состава газовой фазы нужно задать температуру и давление. Общее давление равно сумме равновесных давлений газовых компонентов. Система уравнений будет иметь вид [3]:
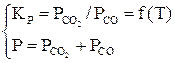 или
или 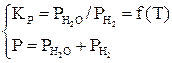 . (25)
. (25)
Далее следует
 или
или 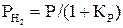 . (26)
. (26)
Соответственно:

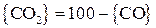 ; (27)
; (27)

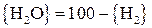 . (28)
. (28)
Пример. Рассчитать равновесные составы газовой фазы в реакциях восстановления оксидов железа водородом при температуре 1200 °С, Р =1 атм.
Решение. При Т = 1200 °С (1473 К) по реакциям (21–23) восстановление оксидов железа сопровождается изменением энергии Гиббса:
 Дж;
Дж;
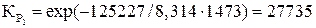 ;
;
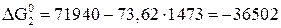 Дж;
Дж;
 ;
;
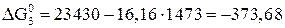 Дж;
Дж;
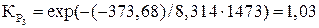 .
.
Для реакции (21)
 ;
;

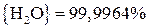 .
.
Для реакции (22)
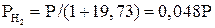 ;
;
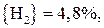
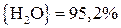 .
.
Для реакции (23)
 ;
;
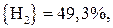
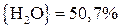 .
.
Задание. Определить равновесные составы газовых фаз реакций восстановления оксидов железа оксидом углерода и водорода при заданной температуре (табл. 6).
|
|
|
Таблица 6
| № варианта | Т, К | № варианта | Т, К | № варианта | Т, К |
Контрольные вопросы
1. Общая схема восстановления оксидов железа газами.
2. Факторы, влияющие на последовательность восстановления оксидов железа.
3. Термодинамические особенности восстановления оксидов железа водородом.
4. Особенности восстановления оксидов железа водородом.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 393; Нарушение авторских прав?; Мы поможем в написании вашей работы!