
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы расчета фазовых превращений
|
|
|
|
Газоконденсатная характеристика залежи
Газоконденсатная характеристика залежи включает комплекс лабораторных и промысловых исследований по определению содержания конденсата, его товарных свойств, условий фазовых превращений в пласте, скважине и наземных коммуникациях, пластовые потери конденсата. Эти данные используются при составлении проекта разработки и эксплуатации газоконденсатного месторождения.
Исследования газоконденсатной характеристики включают определение следующих показателей и параметров.
1. Содержание сырого и стабильного конденсата (в см3) на единицу объема газа при различных давлениях и температурах, а также состав конденсата.
2. Изотермы конденсации для пластового газа.
3. Давления максимальной конденсации при пластовых условиях в пласте.
4. Фазовое состояние газоконденсатной системы в пласте.
5. Состав пластового газа по содержанию различных фракций.
6. Потери конденсата в пласте за период эксплуатации месторождения в зависимости от падения пластового давления при разработке на режиме истощения без поддержания пластового давления.
7. Количество и состав конденсата, извлекаемого из газа по мере падения давления в залежи.
8. Количество конденсата, выделяющегося в стволе скважины.
9. Количество конденсата, остающегося в растворенном состоянии в газе после выхода его из сепараторов разных ступеней.
10. Количество конденсата, который будет выделяться в газопроводе при давлениях и температурах транспорта газа.
В совокупности результаты исследований на газоконденсатную характеристику позволяют оценить пластовые потери конденсата и его добычу за весь период разработки месторождения по всей технологической цепочке «пласт—газопровод».
|
|
|
Для определения фазовых характеристик системы углеводородов в процессе истощения залежи можно воспользоваться и расчетным методом. Для такого расчета необходимо знать константы равновесия индивидуальных углеводородов, начальные давления, температуру пласта и исходный состав углеводородов.
Константы равновесия при помощи которых определяется фазовое состояние углеводородных систем, выражаются следующим образом К=у/х, где К—константа равновесия; у—молярная доля компонента в газовой фазе; х—молярная доля этого же компонента в жидкой фазе, находящейся в равновесии с газовой.
Каждому компоненту смеси при данных температуре и давлении соответствуют свои константы равновесия. Во многих смесях при давлении, значительно меньшем критического, константы равновесия для большинства компонентов не зависит от состава фаз.
Для определения фазового состояния смесей веществ можно использовать закон Рауля и Дальтона. Для данного компонента системы, находящейся в двухфазном состоянии при постоянных температуре и давлении, ур=хр', где р—общее давление системы; р'—давление насыщенного пара данного компонента (парциальное давление).
Преобразование уравнения приводит к выражению этого закона через константу равновесия у/х=р'/р=К.
Однако применение закона Рауля ограничено, во-первых, тем, что некоторые смеси веществ значительно, отклоняются от этого закона вследствие их химической природы, и, во-вторых, тем, что этот закон применим лишь, когда температура смеси ниже критических температур всех входящих в нее компонентов. Ввиду того, что критическая температура метана составляет 820 С, закон Рауля очень редко можно применить для природных газовых смесей, содержащих метан. Для смесей пропана, бутанов, пентанов и других закон Рауля справедлив при температурах до 66° С и давлениях до 0,7 МПа.
|
|
|
Для идеальных условий в уравнение вместо давления можно подставить летучесть: хfж=уfг, где fж—летучесть жидкого индивидуального компонента при равновесных значениях давления и температуры; fг—летучесть газообразного индивидуального компонента при равновесных значениях давления и температуры.
Идеальные константы равновесия были получены на основании равенства К=у/х=fж/fг.

|
 |
Летучесть можно найти экстраполированием и для области температур, превышающих критические. По данным диаграммы рVТ летучесть определяется следующим уравнением:
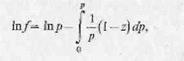
|
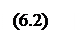 |
где f—летучесть; р—давление; R—газовая постоянная; Т—абсолютная температура, V'—удельный объем, или в форме, удобной для расчета летучести жидких и газообразных веществ графическим методом:
где z—коэффициент сжимаемости.
Вместо идеальных констант можно пользоваться константами равновесия, экспериментально определенными по составу паровой и жидкой фаз.
Константы равновесия, определенные экспериментальным путем при высоких давлениях, близких к давлению однофазного состояния, существенно отличаются от идеальных констант равновесия, полученных на основании закона Рауля.
При давлениях, превышающих давление насыщенного пара, кривые констант равновесия, определенных экспериментальным путем, сходятся в одной точке, где К = 1. Так, для системы пропан — бутан при давлении 7 МПа и температуре 49° С константа равновесия, определенная экспериментально, равна 0,6, в то время как по закону Рауля идеальная константа равновесия равна 0,24. Этот пример показывает, что константы равновесия изменяются в зависимости от состава фаз и могут значительно отклоняться от закона Рауля. Температура 49° С превышает критические ее значения для метана и этана, и поэтому константы равновесия, полученные на основании закона Рауля, 
ненадежны при всех давлениях.
На рис. 6.1 приведены экспериментальные константы равновесия легких углеводородных смесей различного состава при температуре 400 К. Из рисунка видно, что константы равновесия для каждой из смесей сходятся к единице при давлении, называемом давлением схождения.
|
|
|
Если, как в рассматриваемом случае, температура смесей равна критической, то давление схождения для каждой из смесей совпадает с ее критическим давлением. Помимо критической точки, для каждого компонента есть еще одно давление, при котором константа равна единице — давление насыщенных паров компонента при данной температуре. Подобное поведение констант равновесия в зависимости от давления определяется особенностями фазовых превращений углеводородных смесей. В критическом состоянии все свойства газовой и жидкой фаз совпадают. Совпадение составов газовой и жидкой фаз приводит к тому, что константы фазового равновесия, как это следует из уравнения всех компонентов, в критической точке равны единице. Этот факт предопределяет значение характеристик критических точек для оценки фазовых равновесий.
Наличие минимума констант равновесия тяжелых компонентов можно объяснить на примере рассмотрения двойной системы. Самое низкое давление, при котором возможно фазовое равновесие, есть давление пара чистого тяжелого компонента при данной температуре. Как следует из уравнения Рауля—Дальтона, доли этого компонента в газовой и жидкой фазах совпадают, и, следовательно, константа равновесия при этом давлении равна единице. Поскольку константа равновесия тяжелого компонента при давлении его пара и при критическом давлении равна единице, то зависимость константы равновесия от давления должна иметь экстремум.
Так как концентрация тяжелых компонентов в жидкой фазе больше, чем в газовой, их константа равновесия меньше единицы и экстремум есть минимум.
Как было показано, расчетный прогноз фазовых изменений многокомпонентных систем становится настолько сложным, что практически не применяется, а иногда и невозможен. Исследователи давно разрабатывают упрощенные приемы, которые бы позволили расчетным путем определять основные параметры данной углеводородной, в том числе и газоконденсатной системы. Эти приемы, как правило, сводятся к замене определенной группы углеводородов каким-либо одним компонентом, сводя, таким образом, многокомпонентную систему к бинарной, тройной и т. д. Часто в таких методах расчета используются полученные в экспериментальной зависимости и обобщенные данные по реальным месторождениям.
|
|
|
Наиболее трудоемким расчетным методом, но практически не требующим дополнительных данных, является метод расчета фазовых изменений по константам равновесия.
Когда все углеводороды находятся в однофазном состоянии, константы равновесия для всех компонентов равны единице. При снижении давления ниже критического, количество компонентов, выпавших в жидкую фазу, определяется по константам равновесия для этого давления. Обычно расчет ведется при снижении давления по ступеням до некоторого предельного значения, при котором предполагается закончить эксплуатацию пласта.
Рассмотрим многокомпонентную смесь заданного состава, находящуюся в замкнутом сосуде в двухфазном состоянии при условиях термодинамического равновесия. При заданных температуре и давлении общее число молей смеси в сосуде Л' равно сумме числа молей жидкой Nж и газовой Nг фаз, т. е. N=NЖ+NГ.
Каждый компонент распределяется между фазами следующим образом:
 (6.3)
(6.3)
где  , xi, уi—молярные доли i-го компонента, соответственно, в исходной смеси, паровой и жидкой фазах.
, xi, уi—молярные доли i-го компонента, соответственно, в исходной смеси, паровой и жидкой фазах.
Разделив левую и правую части равенства (6.3) на N, получим уравнение материального баланса i-го компонента смеси в сосуде в виде:
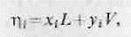
|
 |
где V, L—молярные доли паровой,и жидкой фаз в сосуде.
 |
Подставляя в это уравнение уi = Кiхi и L = 1 — V и разрешая его относительно хi и уi получаем:

|
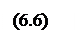 |

|
Рассмотренные выше задачи расчета фазового равновесия по уравнениям (6.5) и (6.6) характеризуются постоянством состава смеси, т. е. процессы являются контактными. Если состав смеси меняется в процессе изменения температуры и давления, т. е. процесс является дифференциальным, то уравнение материального баланса компонентов и замыкающие соотношения будут иными.
Рассмотрим задачу, характерную для процесса разработки газоконденсатных месторождений. В процессе разработки из залежи отбирается газовая фаза. При этом температура и поровый объем остаются постоянными. Для i-го компонента уравнение материального баланса запишется в виде:
 (6.7)
(6.7)
где  xi, уi—молярные доли i-го компонента, соответственно, в исходной смеси, жидкой и газовой фазах; N—число молей исходной смеси; Nсм—суммарное число молей газа и жидкости, оставшихся в пласте после удаления Nотб молей газа; V, L—молярные доли газовой и жидкой фаз после отбора Nотб молей газа; уiотб—молярная доля i-го компонента в отбираемом газе, которая изменяется от
xi, уi—молярные доли i-го компонента, соответственно, в исходной смеси, жидкой и газовой фазах; N—число молей исходной смеси; Nсм—суммарное число молей газа и жидкости, оставшихся в пласте после удаления Nотб молей газа; V, L—молярные доли газовой и жидкой фаз после отбора Nотб молей газа; уiотб—молярная доля i-го компонента в отбираемом газе, которая изменяется от  до уi.
до уi.
Вводя в уравнение (6.7) константы равновесия, т. е. заменяя хi=уi/ Кi, учитывая, что L=1— V, Nсм = N—Nотб и деля на N, получаем
 (6.8)
(6.8)
Для системы, состоящей из n компонентов, будем иметь n таких уравнений, в которых i последовательно принимает значения от 1 до n. Эта система уравнений связана соотношением
 (6.9)
(6.9)
Замыкающее уравнение выводится из условия постоянства объема системы 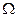 .
.
Подставляя в выражение (6.8) Nсм = N0—Nотб и деля обе части на No, получаем
 (6.10)
(6.10)
где z0—коэффициент сжимаемости исходной пластовой системы; Ро—начальное пластовое давление, равное давлению перехода системы в однофазное состояние; Т—температура пласта; р—давление, которое устанавливается в пласте после отбора Nотб молей газа; z—коэффициент сжимаемости газовой фазы после отбора Nотб молей газа; ржрt—плотность жидкой фазы.
Зависимости 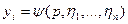 и
и  являются искомыми.
являются искомыми.
Для упрощения решения задачи весь процесс снижения давления в пласте разбивается на ряд этапов, в конце каждого из которых последовательно находятся количество и составы газовой и жидкой фаз.
Примем, что в течение каждого этапа отбирают одинаковое число молей газа, т.е. N0тб= N0/m, где m—число этапов. Примем также, что состав отбираемой газовой фазы в течение каждого этапа является средним по отношению к составам газовых фаз в начале и конце этого этапа, т. е. для j-го этапа
 (6.11)
(6.11)
где yij-1, yij—соответственно молярные доли i-го компонента в конце j-1 и j этапов.
Записывая уравнение (4.9) в конечно разностной форме на конец j-го этапа, получаем
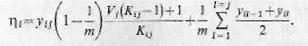 (6.12)
(6.12)
Учитывая, что в начале i-го этапа состав газовой фазы равен исходному составу смеси, т. е. yi0 =  запишем
запишем
 (6.13)
(6.13)
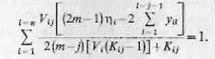
|
 |
Разрешая уравнение (6.12) относительно yij с учетом выражения (6.13) и суммируя по всем компонентам, согласно уравнению (6.9) получаем
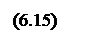 |
Объем системы в конце j-го этапа

|
Принимая в первом приближении, что объем жидкой фазы не меняется в течение всего этапа, а также Vj=Vj-1 и zj=zj-1, получаем

(6.16)
Исходя из этого давления, определяют константы равновесия Кij. Подставляя константы равновесия в уравнение (6.14), находят Vj, xij, уij. По составам газовой и жидкой фаз определяют zj, Мжj, ржрti.
Подставляя полученные в первом приближении значения величин zj, Мжj, ржрti в уравнение (6.15), находят значения давления рj во втором приближении. Исходя из этого давления, повторяют расчет в той же последовательности и вычисляют давление в третьем приближении, и т. д. до тех пор, пока предыдущее и последующее значения давления не совпадут. Полученные при этом давлении количество и состав фаз являются окончательными для конца j-го этапа и исходными данными для следующего этапа. Расчет ведут последовательно, начиная с первого этапа.
Предположим, что необходимо прогнозировать фазовые изменения системы углеводородов, насыщающих пласт, состав которой (в молях), а также давление начала конденсации и температура известны (табл. 6.1). Прежде всего определяем объем, занимаемый 100 молями газа в пласте. Критические температура и давление системы: Tкр. с = 238 К, Pкр.с=4,62 МПа. Приведенные температуры и давление Тпр = 376/238 = 1,58, рпр = 26,8/46,2 = 0,58. Находим коэффициент сжимаемости z, равный для этого случая 0,875. Определяем объем, занимаемый газом: Vг=nzRТ/р = 100 ∙ 0,875 ∙ 376 ∙ 848/(26,8 ∙ 104) = 10,41 м3. Объем жидкости равен нулю.
Примем, что давление снизилось на 2,2 МПа, до 24,6 МПа. Часть углеводородов конденсируется, и состав газовой фазы изменяется. Средний состав продукции, добытой при снижении давления до 24,6 МПа, определяется полусуммой составов углеводородов при давлении 26,8 и 24,6 МПа, т. е. сложением начального и предполагаемого составов и делением суммы на 2. Рассчитанный, таким образом, средний состав продукции приведен в гр. 5.
Далее принимаем, что число молей продукции, которое отбирается при падении давления до 24,6 МПа равно 6,8. Тогда, умножая число молей на средний состав, получаем число молей каждого компонента (гр. 6). Эти значения вычитаются из общего числа молей, соответствующих начальному давлению. В результате получается число молей каждого компонента, содержащегося в пласте в конце данного интервала снижения давления (гр. 7). Объем жидкой и газообразной фаз системы при давлении 24,6 МПа определяется по уравнению
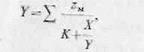
(6.17)
где Y—моли пара; X—моли равновесной жидкости; zМ—молярная доля компонента в общем количестве смеси; К—константа равновесия. Константы равновесия (гр. 8) определяются по опубликованным данным. Результаты расчета приводятся в гр. 9, 10, 11 и 12. Затем рассчитанный состав газовой фазы при давлении 24,6 МПа (гр. 11) сравнивается с предполагаемым составом (гр. 4). Как видно из табл. 4.1, совпадение довольно хорошее.
После того, как подтверждена правильность предположительно взятого состава газа при давлении 24,6 МПа, проверяется, правильно ли взят объем добытого газа. Для этого определяется объем, занимаемый углеводородами (в жидкой и газовой фазах) в пласте при давлении 24,6 МПа. По приведенным давлению и температуре находим: Tкр. с = 234 К: Тпр = 376/234 =1,6; pкр. с = 4,64 МПа; рпр = 24,6/4,64 = 5,305; z = 0,86; Vп = nzRТ/р = 90,9920,86 ∙ 848 ∙ 376/(24,6 ∙ 104)= 10,13 м3.
Объем жидкости (конденсата), имеющего молекулярную массу M=63,91 и плотность р = 0,555 г/см3. Vк = Мх/р = 63,91 -2,278/0,555 = = 0,263 м3 (где х—число молей жидкости (гр. 7 минус гр. 10).
Общий объем, занимаемый углеводородами в пласте при давлении 24,6 МПа, равен 10,13 + 0,263= 10,393 м3. Следовательно, все допущения, принятые в процессе расчета, оказались правильными.
Подобным же образом рассчитывают фазовые изменения и для следующих интервалов снижения давления, пока оно не достигнет предельного значения. Кроме всего прочего, по данным этих расчетов можно построить изотермы конденсации.
Можно заменить все многообразие газоконденсатной и тройной систем. Исследуя ее фазовые изменения и сравнивая результаты с поведением различных систем реальных газоконденсатных месторождений, можно установить форму взаимосвязи, которой можно пользоваться для практических целей. В частности, для этой цели можно воспользоваться системой метан — пропан—н-октан.
Таблица 6.1

|
При переходе от системы реальных углеводородов к тройной системе за критерий принималось равенство молекулярной массы пропана молекулярной массе группы промежуточных углеводородов (первый компонент тройной смеси соответствует метану + азот).
Результаты исследования показывают, что параметры определяются тем точнее, чем ближе средняя молекулярная масса третьей группы углеводородов (тяжелых) к молекулярной массе н-октана.
Для практических целей неравновесные фазовые переходы удобно рассчитывать на основе идентификационной модели. Будем моделировать реальную углеводородную систему бинарной моделью. Предположим, что равновесная изотерма растворимости описывается линейным законом Генри
Г=αр (6.18)
где Г—количество растворенного газа (газовый фактор) при давлении р в единице объема жидкости; α— коэффициент растворимости Генри. Примем, что неравновесный процесс описывается уравнением
 (6.19)
(6.19)
где Т—время релаксации.
При медленном (равновесном) изменении р и Г, когда dГ/dt≈0 уравнение (4.16) будет соответствовать закону Генри. При снижении давления dГ/dt<0 и сумма 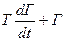 согласно (4.16) равна текущему значению αр, текущее Г будет больше, чем равновесное значение, соответствующее тому же давлению р. Если же р увеличивается, то dГ/dt>0, и соответствующее значение Г будет меньше равновесного.
согласно (4.16) равна текущему значению αр, текущее Г будет больше, чем равновесное значение, соответствующее тому же давлению р. Если же р увеличивается, то dГ/dt>0, и соответствующее значение Г будет меньше равновесного.
Решая линейное неоднородное дифференциальное уравнение первого порядка (4.16) относительно Г, получаем его аналог в интегральной форме:
 (6.20)
(6.20)
При очень малых темпах изменения давления dP/dt≈0 уравнение (6.20) соответствует закону Генри. То же самое происходит при  , т. е. при мгновенной релаксации. При нарушении равновесных условий dp/dt ≠ 0. Пусть, например, давление снижается и происходит дегазация. Тогда dp/dt<0 и Г>а.р, т. е выделение газа уменьшается по сравнению с равновесным процессом. При повышении давления dp/dt>0 и наблюдается обратная картина. Это означает, что неравновесность процесса обусловливает гистерезис растворения и выделения газа и жидкости.
, т. е. при мгновенной релаксации. При нарушении равновесных условий dp/dt ≠ 0. Пусть, например, давление снижается и происходит дегазация. Тогда dp/dt<0 и Г>а.р, т. е выделение газа уменьшается по сравнению с равновесным процессом. При повышении давления dp/dt>0 и наблюдается обратная картина. Это означает, что неравновесность процесса обусловливает гистерезис растворения и выделения газа и жидкости.
Для проверки адекватного описания моделью (6.20) реальных процессов, протекающих при фазовых превращениях, была проведена серия типовых экспериментов.
Газожидкостная система представляла собой смесь трансформаторного масла с углекислым газом. Объем жидкой фазы Vж = 200 см3. Объем углекислого газа при нормальных условиях составлял 10,6 дм3. Давление насыщения системы, т. е. давление, при котором происходило полное растворение газовой фазы в 200 см3 жидкой фазы равнялось 3,65 МПа. Исходный газовый фактор составленной смеси Го = 53 см3/см3.
Составленную газожидкостную систему подвергали контактной дегазации в бомбе рVТ с постоянными темпами изменения давления. Темпы давления были выбраны такими, чтобы система отклонялась от равновесных условий, и составляли 0,02; 0,04; 0,06; 0,08 МПа/мин.
Результаты экспериментов для выбранных темпов приводятся на рис. 6.2.
Для сравнения кинетики процесса дегазации при различных темпах по экспериментальным данным строят графики в координатах Гв = Гв(р), где Гв— количество выделившегося газа в единице объема жидкости. Прямыми линиями приведена равновесная зависимость Гв = Г0-αр.
Анализ результатов показал, что с увеличением темпа снижения давления зависимость Гв = Гв(р) все больше отклоняется от равновесной изотермы.
Анализ экспериментальных зависимостей Гв = Гв(р) (см. рис. 6.2) показывает, что они смещены от равновесной зависимости, и это смешение Δр достигает со временем некоторого установившегося значения, зависящего от темпа снижения давления в опыте.

|
 |
Пользуясь выражением (4.17), определяем уравнение для Δр. Уравнение (4.17) с учетом постоянства dр/dt = α примет вид:

|
 |
Это же значение газового фактора Гв на равновесной кривой разгазирования будет иметь место при давлении р + Δр, т. е.
 
|

|
 |
Вычитая уравнение (4.18) из выражения (4.19), получаем
 |
Зная вид весовой функции (4.17), находим значение ΔPнас достигаемое на асимптоте:

|
За динамическое давление насыщения Pд нас принимается величина Рнас—ΔРнас, соответствующая давлению, ниже которого начинается интенсивное выделение газа из смеси.
Расчетные значения Pд нас, полученные на основании выражения (6.22) для темпов изменения давления, имевших место в опытах, а также значения динамического давления насыщения, определенные графически на рис. 6.2, приведены ниже.
dр/dt, МПа/мин........................................... 0,02 0,04 0,06 0,08
Pд нас, МПА (расчетное)............................... 3,2 2,8 2,5 2,0
Pд нас, МПа (опытное)................................... 3,2 2,9 2,5 2,1
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 1595; Нарушение авторских прав?; Мы поможем в написании вашей работы!