
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ферменты как биологические катализаторы
|
|
|
|
Ферменты – специфические белки, присутствующие во всех клетках и играющие роль биологических катализаторов. Для биохимические реакции в живых клетках определенные условия (температура, давление, рН). Но даже при их наличии скорость реакций все равно остается очень медленной, если в ней не участвуют ферменты. Ферменты ускоряют ход реакции без изменения ее общего результата за счет снижения энергии активации, т.е. в их присутствии требуется значительно меньше энергии для придания реакционной способности молекулам. С участием ферментов совершаются прямо или косвенно все процессы в живом организме. Поэтому нарушение синтеза ферментов или недостаточная их активность нередко ведут к возникновению тяжелых болезней (сахарный диабет, фенилкетонурия, галактоземия и др.).
Ферменты обычно состоят из нескольких полипептидных цепей и имеют четвертичную структуру. В состав, кроме белковой части – апофермента – может входить и небелковая часть – кофактор (неорганическое вещество; Zn2+, Mg2+) или кофермент (низкомолекулярное органическое вещество; витамины, убихинон – Q10). Витамины являются предшественниками или составными частями многих коферментов: пантотеновая кислота – составная часть кофермента А, никотиновая кислота – предшественник НАД и НАДФ и т.д.
Теория активного центра.
Для ферментов характерна высокая степень специфичности (фермент катализирует только одну реакцию или действует только на один тип связи), что обеспечивает тонкую регуляцию всех жизненно важных процессов (фотосинтез, дыхание, пищеварение и др.), протекающих в клетке и организме. Так, фермент уреаза катализирует расщепление только мочевины, не оказывая каталитического воздействия на структурно-родственные соединения. Такая специфичность обусловлена наличием одного или нескольких активных центров.
|
|
|
Активный центр фермента – участок, в котором происходит тесный контакт между молекулами фермента и субстрата - вещества, на которое он действует. Активным центром может быть:
- функциональная группа (ОН-группа серина);
- отдельная аминокислота;
- сочетание 3-12 аминокислотных остатков, расположенных в определенном порядке.
Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные субстраты ы силу идеального соответствия их пространственных структур (как ключ и замок). Вокруг крупной молекулы фермента возникает сильное электрическое поле, которое ориентирует молекулы субстрата определенным образом и деформирует их. В результате химические связи ослабляются, и катализируемая реакция происходит с меньшей начальной затратой энергии, а, следовательно, с большей скоростью (одна молекула каталазы за 1 минуту может расщепить более 5 млн. молекул пероксида водорода, который возникает при окислении в организме различных соединений). На заключительном этапе химической реакции фермент-субстратный комплекс распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр может принимать новые молекулы.
Некоторые ферменты, кроме активного центра имеют один или несколько регуляторных центров, с которыми могут связываться модуляторы – молекулы, регулирующие активность фермента. Молекулы веществ, снижающие или блокирующие активность фермента, называют ингибиторами. Скорость ферментативных реакций зависит от ряда факторов: природы и концентрации фермента и субстрата, температуры, давления, реакции среды, наличия ингибиторов и т.д. Влияние температуры на скорость ферментативных реакций можно проиллюстрировать следующим примером: при температурах, близких к нулю скорость биохимических реакций замедляется до минимума (при трансплантации для сохранения донорских органов; быстрое замораживание предохраняет пищевые продукты от разложения, предотвращая рост и размножение микроорганизмов, инактивируя их пищеварительные ферменты).
|
|
|
6. Нуклеиновые кислоты. ДНК: строение, свойства и функции. РНК: строение, виды, функции.
Нуклеиновые кислоты – это фосфорсодержащие нерегулярные гетерополимеры. Открыты в 1868 Г.Ф. Мишером.
Нуклеиновые кислоты содержатся в клетках всех живых организмов. Причем, каждый вид организмов содержит свой, характерный только для него набор нуклеиновых кислот. В природе насчитывается более 1 200 000 видов живых организмов – от бактерий и человека. Это значит, что существует около 1010 различных нуклеиновых кислот, которые построены всего лишь из четырех азотистых оснований. Каким образом четыре азотистых основания могут закодировать 1010 нуклеиновых кислот? Приблизительно так же, как и мы кодируем наши мысли на бумаге. Мы устанавливаем последовательность из букв алфавита, группируя их в слова, а природа кодирует наследственную информацию, устанавливая последовательность из множества нуклеотидов.
Нуклеотид – сравнительно простой мономер, из молекул которого построены нуклеиновые кислоты. Каждый нуклеотид состоит из: азотистого основания, пятиуглеродного сахара (рибозы или дезоксирибозы) и остатка фосфорной кислоты. Главной частью нуклеотида является азотистое основание.
Азотистые основания имеют циклическую структуру, в состав которой наряду с другими атомами (С, О, Н) входят атомы азота. Благодаря этому эти соединения получили название азотистые. С атомами азота связаны и важнейшие свойства азотистых оснований, например, их слабоосновные (щелочные) свойства. Отсюда эти соединения и получили название «основания».
В природе в состав нуклеиновых кислот входят всего пять из известных азотистых оснований. Они встречаются во всех типах клеток, начиная от микоплазм и до клеток человека.
Это пуриновые азотистые основания Аденин (А) и Гуанин (Г) и пиримидиновые Урацил (У), Тимин (Т) и Цитозин (Ц).Пуриновые основания являются производными гетероцикла пурина, а пиримидиновые – пиримидина. Урацил входит только в состав РНК, а тимин – в ДНК. А, Г и Ц встречаются как в ДНК, так и в ДНК.
|
|
|
В составе нуклеиновых кислот встречаются два типа нуклеотидов: дезоксирибонуклеотиды – в ДНК, рибонуклеотиды – РНК. Структура дезоксирибозы отличается от структуры рибозы тем, что при втором атоме углерода дезоксирибозы нет гидроксильной группы.
В результате соединения азотистого основания и пентозы образуется нуклеозид. Нуклеозид, соединенный с остатком фосфорной кислоты – нуклеотид:
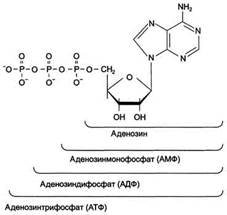 азотистое основание + пентоза = нуклеозид + остаток фосфорной кислоты = нуклеотид
азотистое основание + пентоза = нуклеозид + остаток фосфорной кислоты = нуклеотид
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 1349; Нарушение авторских прав?; Мы поможем в написании вашей работы!