
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общетеоретическая часть. Химическая термодинамика
|
|
|
|
Химическая термодинамика
Этот раздел изучает переходы энергии из одной формы в другую при химических реакциях и устанавливает направление и пределы их самопроизвольного протекания.
Процессы, протекающие в системе, характеризуются различными изменениями параметров. Если не изменяется объём системы (V = const и Δ V = 0), то процесс называется изохорным, при постоянном давлении (Р = = const, и Δ Р= 0) процесс называется изобарным. Если не изменяется температура (Т= const, а ΔТ = 0), процесс называется изотермическим.
Тепловые эффекты изобарно-изотермических реакций определяются изменением энтальпии (∆ H x.p.), которые рассчитывают по уравнению: 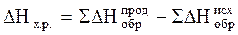 , являющимся математическим выражением следствия закона Гесса: тепловой эффект химической реакции (∆Hx.p.) равен сумме теплот образования продуктов реакции (∆H
, являющимся математическим выражением следствия закона Гесса: тепловой эффект химической реакции (∆Hx.p.) равен сумме теплот образования продуктов реакции (∆H  ) за вычетом суммы теплот образования исходных веществ (∆H
) за вычетом суммы теплот образования исходных веществ (∆H  ) с учётом стехиометрических коэффициентов. Например, для системы
) с учётом стехиометрических коэффициентов. Например, для системы
2C6H6(ж) + 15O2(г) = 12CO2(г) + 6H2O(ж),
∆Hº x.p.= 6∆Hºобр(H2O ж) + 12∆Hºобр(CO2 г) – 2∆Hºобр (С6H6 ж).
Величина ∆H  простых веществ, находящихся в термодинамически устойчивых при данных условиях фазовых и агрегатных состояниях, равна нулю.
простых веществ, находящихся в термодинамически устойчивых при данных условиях фазовых и агрегатных состояниях, равна нулю.
Индекс «0» означает стандартное значение энтальпии.
Если теплота выделяется в результате реакции, то ΔH < 0 (экзотермическая реакция), поглощается (ΔH > 0) – эндотермическая реакция. В случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведённой при постоянной температуре и постоянном давлении.
∆ Η = - Q.
Раздел химии, изучающий тепловые эффекты, получил название термохимии.
Уравнения реакций, в которых указан тепловой эффект, называются термохимическими.
|
|
|
Значение энтропии S характеризует меру неупорядоченности системы. Её изменение можно рассчитать по уравнению:
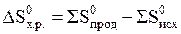 .
.
В ряде случаев оценить знак изменения энтропии можно, не прибегая к расчётам. Для этого достаточно определить, с увеличением или уменьшением объёма газообразных веществ протекает реакция. В первом случае  .
.
Для изобарно-изотермических процессов возможность самопроизвольного протекания реакции определяется знаком величины изменения энергии Гиббса  . Если
. Если 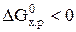 , то данная реакция может самопроизвольно протекать (при p = const и Т = const). Величину
, то данная реакция может самопроизвольно протекать (при p = const и Т = const). Величину  можно рассчитать по уравнению
можно рассчитать по уравнению

или на основе значений ∆ H и ∆S:
∆ G = ∆ Н – Т ∆ S.
Химическому равновесию отвечает условие ∆ G = 0. Равновесную температуру тогда можно рассчитать по уравнению:
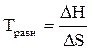 .
.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 591; Нарушение авторских прав?; Мы поможем в написании вашей работы!