
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общетеоретическая часть. Комплексные соединения
|
|
|
|
Комплексные соединения
Методика решения типовых заданий
Задание. Каким образом протекает коррозия железа в контакте с медью в атмосфере и в кислой среде?
Решение:
Подвергаться разрушению будет железо, как более активный металл:
Анод (Fe): Fe – 2ē = Fe2+.
Электроны переходят от железа к меди (катоду), на котором происходит восстановление растворённого в воде кислорода:
Катод (Cu): 2H2O + O2 + 4ē = 4OH–.
В результате движения ионов образуется гидроксид железа (II):
Fe2+ + 2OH– = Fe(OH)2.
В данном конкретном случае из-за склонности Fe(OH)2 к окислению и неустойчивости возможны вторичные процессы:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)3 = H2O + FeООН.
В кислой среде для данной контактирующей пары металлов процессы имели бы вид:
Анод (Fe): Fe – 2ē = Fe2+;
Катод (Cu): 2H+ + 2ē = H2↑.
Задания к самостоятельной работе
81. Составьте схему электролиза расплава и водного раствора KOH (анод угольный).
82. Какие процессы протекают на платиновых электродах при электролизе водного раствора NiSO4?
83. При электролизе водного раствора хлорида кальция на одном из угольных электродов выделилось 14,2 г хлора. Какой газ и в каком объёме выделился на другом электроде?
84. Составьте схемы электролиза водных растворов CuCl2 и Pb(NO3)2 с платиновыми электродами.
85. Составьте схемы электролиза водных растворов AgNO3, если: а) анод угольный; б) анод серебряный.
86. Вычислите массу металла, выделившегося на катоде, и объём газа, образовавшегося на аноде при пропускании тока силой 5 А через раствор нитрата меди (II) в течение 30 минут.
87. При электролизе соли некоторого двухвалентного металла в течение 1,0 часа при силе тока 1,5 А выделилось 1,8 г этого металла. Что это за металл?
88. Составьте уравнения процессов, протекающих при атмосферной коррозии лужёного железа при нарушении покрытия.
|
|
|
89. Железное изделие частично покрыто никелем. Какое это покрытие – анодное или катодное? Составьте уравнения процессов, протекающих при коррозии этого изделия в атмосфере и в соляной кислоте.
90. В раствор серной кислоты поместили две цинковые пластинки, одна из которых частично покрыта медью. В каком случае процесс коррозии будет интенсивнее? Почему?
Комплексными называются соединения, содержащие комплексные ионы, способные самостоятельно существовать в растворах. В структуре комплексных соединений различают координационную (внутреннюю) сферу – группировку, состоящую из центральной частицы – комплексообразователя – и окружающих его лигандов.
В формулах комплексных соединений координационная сфера обозначается квадратными скобками. Число лигандов, располагающихся вокруг комплексообразователя, называется координационным числом. Ионы, находящиеся за пределом внутренней сферы, образуют внешнюю сферу комплекса.
Комплексообразование особенно характерно для ионов переходных металлов, в частности для ионов Cu2+, Ag+, Au3+, Cr3+, Zn2+, Fe2+, Fe3+ и др.
Лигандами в комплексных соединениях часто бывают ионы галогенов, CN–, SCN–, 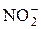 , OH–,
, OH–, 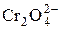 ,
,  , а также нейтральные молекулы, например H2O, NH3.
, а также нейтральные молекулы, например H2O, NH3.
Координационное число (К.Ч.) определяется зарядом и размерами комплексообразователя и лигандов.
Строение комплексных соединений рассмотрим на примере Na[Cr(NH3)2Cl4].
  Комплексообразователь лиганды
â å æ
Na[Cr(NH3)2Cl4]
ä ã
внешняя сфера комплексный ион Комплексообразователь лиганды
â å æ
Na[Cr(NH3)2Cl4]
ä ã
внешняя сфера комплексный ион
|
Заряд комплексного иона равен сумме зарядов комплексообразователя и лигандов. В зависимости от знака заряда комплексного иона различают комплексы:
а) катионные – [Сu(NH3)4]Cl2, [Cr(H2O)6](NO3)3 и т.п.;
б) анионные – Na[Cu(NH3)Cl3], К4[Fe(CN)6] и т.п.;
в) нейтральные – [Zn(NH3)2Cl2], [Pt(NH3)2Cl2].
Связь между комплексообразователем и лигандами – донорно-акце-пторная, а между внутренней и внешней сферами – ионная, поэтому комплексные соединения в растворах диссоциируют на комплексные ионы и ионы внешней сферы. Нейтральные комплексы являются неэлектролитами.
|
|
|
Например: [Cr(NH3)4Cl2]Cl ⇄ [Cr(NH3)4Cl2]+ +Cl¯.
Устойчивость комплексных ионов неодинакова и определяется величиной константы нестойкости (Кн).
[Cr(NH3)4Cl2]+ ⇄ Cr3+ + 4 NH30 + 2Cl¯;
 .
.
Чем меньше значение Кнест., тем более устойчив комплексный ион.
От комплексных солей следует отличать двойные соли,которые в водном растворе диссоциируют на все виды ионов, входящих в их состав:
КАl(SO4)2⇄ K+ + Al3+ + 2SO42-.
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 404; Нарушение авторских прав?; Мы поможем в написании вашей работы!