
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Доцільність використання комп’ютерних технологій при вивченні хімії
|
|
|
|
Визначення сучасного етапу розвитку суспільства, інтенсивний розвиток сучасних інформаційно-комунікативних технологій, визнання необхідності освіти протягом всього життя людини - все це визначає необхідність широкого використання інформаційних технологій в системі освіти в цілому та при викладанні природничих дисциплін зокрема.
Сучасні інформаційні технології – це форми і методи передачі інформації при допомозі новітніх засобів та пристроїв зв'язку (телебачення, комп'ютеризація, Інтернет та мобільна мережа зв'язку). Інформаційно-комунікаційні технології – це сукупність методів, засобів і прийомів, що використовуються для добору, опрацювання, зберігання, подання, передавання різноманітних даних і матеріалів, необхідних для підвищення ефективності різних видів діяльності.
На думку доктора технічних наук, професора, академіка НАПНУ В.Ю.Бикова «на основі поєднання традиційних педагогічних та інформаційно-комунікаційних технологій навчання вдається значно ефективніше розвинути і примножити природні задатки і здібності людини. Використання цих технологій у процесі навчання створює додаткові умови і спричинює появу нових цілей та оновлення змісту освіти, дає змогу досягти значно більших результатів навчальної діяльності, забезпечити для кожного учня формування і розвиток їхньої власної освітньої траєкторії».
Розглядаючи проблему інтеграції ІКТ у освітньому процесі, варто зазначити, що на сучасному етапі значна увага приділяється матеріально-технічному, програмному, методичному забезпеченню щодо використання ІКТ у навчально-виховному процесі. Проведення моніторингових, аналітичних та інших досліджень на рівні держави, участь у міжнародних проектах, сприяє виробленню стратегічних підходів до впровадження ІКТ у навчальний процес, що значною мірою сприяє виявленню тенденцій та аналізу проблем і просуває їх розв'язання. Сьогодні в Україні на державному рівні робляться певні кроки для впровадження ІКТ у освітній процес.
|
|
|
Інформатизація суспільства пов’язана, насамперед, з розвитком комп’ютерної техніки, різноманітного програмного забезпечення, глобальних мереж (Інтернет) та мультимедійних технологій.
Мультимедійні засоби навчання займають важливе місце у розвитку інформаційного суспільства. Мультимедійні засоби навчання за С.У. Гончаренко – це комплекс апаратних і програмних засобів, що дозволяють користувачеві спілкуватися з комп’ютером, використовуючи різноманітні, природні для себе середовища: графіку, гіпертексти, звук, анімацію, відео. Мультимедійні системи надають користувачеві персонального комп’ютера такі види інформації: текст; зображення; анімаційні картинки; аудіо коментарі; цифрове відео. Технології, які дозволяють з допомогою комп’ютера інтегрувати, обробляти і водночас відтворювати різноманітні типи сигналів, різні середовища, засоби і способи обміну інформацією, називаються мультимедійними.
Нові мультимедійні засоби, в яких використовується аудіо-візуальний формат, надають такі можливості, які традиційні підручники надати не можуть.І.В. Ставицька пропонує різні способи застосування засобів мультимедіа в навчальному процесі, серед яких:
- використання електронних лекторів, тренажерів, підручників, енциклопедій;
- розробка ситуаційно-рольових та інтелектуальних ігор з використанням штучного інтелекту;
- моделювання процесів і явищ;
- забезпечення дистанційної форми навчання;
- проведення інтерактивних освітніх телеконференцій;
- побудова систем контролю й перевірки знань і умінь студентів (використання контролюючих програм-тестів);
- створення і підтримка сайтів навчальних закладів;
- створення презентацій навчального матеріалу;
- здійснення проективної і дослідницької діяльності студентів тощо [1].
2.Компютерні технології при вивченні теми «Електролітична дисоціація»
|
|
|
Більшість хімічних реакцій, які використовуються у якісному аналізі, протікають у водних розчинах. Якщо речовина розчиняється у воді чи іншому розчиннику, то утворюється однорідний гомогенний розчин. Розчини не можна розглядати як прості механічні суміші. Процес розчинення завжди супроводжується виділенням чи поглинанням теплоти.
Водні розчини деяких речовин є провідниками електричного струму. Ці речовини належать до електролітів. Електролітами є кислоти, солі та луги. Багато речовин виявляють властивості електролітів у розплавленому стані. Електрична провідність розчинів і розплавів електролітів зумовлена наявністю у розчині негативно та позитивно заряджених іонів, які утворюються з молекул або кристалічних речовин. Уявлення про утворення іонів у розчинах електролітів утвердилося в хімії в першій половині XIXст. завдяки працям англійського фізика і хіміка М. Фарадея. Процес розщеплення електролітів на іони у водних розчинах і розплавах називається електролітичною дисоціацією.
Розчини деяких речовин у воді не проводять електричний струм. Такі речовини називаються неелектролітами. Неелектролітами є багато органічних сполук, наприклад сахари, спирти.
Теорія електролітичної дисоціації для водних розчинів була сформульована шведським ученим С. Арреніусом у 1887 р. Розглянемо основні положення цієї теорії.
1. При розчиненні у воді молекули електролітів дисоціюють (розщеплюються) на позитивно і негативно заряджені іони. Іони можуть бути утворені з одного атома – прості іони (Na+, Cl-) і кількох атомів – складні іони ( ).
).
2. Дисоціація – оборотний процес. Як правило, він
не відбувається до кінця, а в системі встановлюється динамічна рівновага, тобто такий стан, при якому швидкість дисоціації дорівнює швидкості зворотного процесу - утворення вихідних молекул. Тому у рівняннях дисоціації замість знака „ дорівнює ” ставлять знак оборотності,
наприклад:
|
|
|

3. Іони у водному розчині перебувають у хаотичному безперервному русі. Якщо у розчин електроліту занурити електроди і прикласти до них електричну напругу, то іони набудуть направленого руху: позитивно заряджені іони переміщуватимуться у напрямі до катода (негативно зарядженого електрода), а негативно заряджені іони у напрямку анода (позитивно зарядженого електрода). Іони також одержали назви: позитивні іони – аніони, а негативні – катіони.
Теорія С. Арреніуса не пояснює причин електролітичної дисоціації, вони були встановлені пізніше.
Розглянемо електролітичну дисоціацію речовин з іонним і полярним ковалентним зв'язком. Припустимо, що у воду помістили кристали хлориду натрію NаСІ – речовини з іонним зв’язком. Полярні молекули води електростатично притягуються позитивно зарядженими кінцями до негативно заряджених іонів С1- у хлориді натрію, а негативно зарядженими кінцями – до позитивно заряджених іонів Na+ (див. рис. 1).

Рис. 1. Схема дисоціації хлориду натрію у водному розчині
Внаслідок такої взаємодії іонів з диполями води послаблюється зв’язок між іонами кристала, і вони переходять у розчин у вигляді гідратованих іонів. Уявлення про гідратацію іонів, тобто про виникнення хімічного зв'язку між іонами і молекулами води, введено російським вченим І. О. Каблуковим і стало розвитком хімічної теорії розчинів.
У неводних розчинниках також можлива електролітична дисоціація з утворенням соль ватованих іонів.
Гідратації зазнають всі іони у водних розчинах, у тому числі й іони водню, які можуть утворювати хімічні зв’язки з однією, двома і більшим числом молекул води. Звичайно гідратовані іони водню зображують формулою Н3 О+ (точніше, Н3 О+ ЧnН2 О, де n = 0...4) і називають іоном гідроксонію.
На рис. 2 зображено схему розщеплення молекули хлороводню з полярним ковалентним зв'язком. При взаємодії полярної молекули НС1 з диполями води відбувається розрив зв'язку між атомами водню і хлору, і молекула набуває іонної структури. Потім молекула із іонним зв’язком розщеплюється на окремі гідратовані іони.
|
|
|
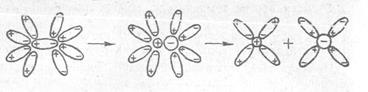
Рис. 2 Схема дисоціації молекули хлороводню у водному розчині
Для кількісної характеристики електролітичної дисоціації введено поняття ступінь дисоціації,який дорівнює відношенню кількості речовини електроліту, що розщепився на іони, до загальної кількості речовини цього електроліту, введеного в розчин:

Ступінь дисоціації– безрозмірнавеличина, його виражають у частках одиниці або в процентах. При повній дисоціації електроліту на іони ω= 1, або 100 %. Для неелектролітів, які не дисоціюють на іони, ω = 0.
Ступінь дисоціації залежить від концентрації електроліту і температури. З теорії електролітичної дисоціації випливає, що чим менша концентрація електроліту в розчині, тим більший ступінь дисоціації. При безкінечному розбавлянні розчину ступінь дисоціації наближається до 1 (100 %). Наприклад, ступінь дисоціації гідроксиду натрію NаОН залежно від концентрації електроліту змінюється так: для розчину з концентрацією с=1 моль/л ω = 0,73 (18°С), для с = 0,1 моль/л ω =0,84 і для с = 0,01 моль/л ω = 0,95.
Залежно від ступеня електролітичної дисоціації всі електроліти поділяють на сильні та слабкі. Такий поділ досить умовний, оскільки ступінь дисоціації залежить від температури розчину, концентрації електроліту, і внаслідок цього може змінюватися у досить широких межах.
Слабкі електроліти – це речовини, які лише частково дисоціюють на іони. Із неорганічних сполук до них належить вода, пероксид водню, деякі неорганічні кислоти, як, наприклад, вугільна Н2 СО3. Силу електроліта зручно характеризувати за допомогою константи дисоціації:

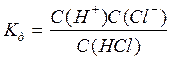
Якщо електроліт дисоціює ступінчато, то константу дисоціації слід записати для кожного ступеня дисоціації. Виходячи із значень константи дисоціації можна визначати та порівнювати силу електролітів, чим менше Кд тим електроліт слабший і навпаки.
Для слабких електролітів між константою та ступенем дисоціації існує зв’язок, який для розбавлених розчинів можна виразити формулою:
 ,
,
де с – молярна концентрація електроліту.
Сильні електроліти практично повністю дисоційовані на іони. До них відносять майже всі неорганічні кислоти (сульфатна, нітратна, хлоридна) та їх розчинні солі, луги.
Електростатична взаємодія із утворенням іонних пар зменшує реальну концентрацію іонів у розчині, а отже ступінь дисоціації електроліту менший за 100 %. Ступінь дисоціації сильного електроліту. Який визначають експериментально називають уявним ступенем дисоціації. Тому замість концентрації використовують активність. Активність – це ефективна концентрація іонізованої частини електроліту в розчині, визначена із врахуванням взаємодії іонів: 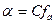 , де
, де  - це коефіцієнт активності речовини, який враховує сили взаємодії іонів, значення, якого завжди менше або дорівнює одиниці.
- це коефіцієнт активності речовини, який враховує сили взаємодії іонів, значення, якого завжди менше або дорівнює одиниці.
П. Дебай та Г. Гюккель встановили, що в розведених розчинах сильних електролітів логарифм коефіцієнта активності пропорційний кореню квадратному із його іонної сили: 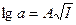 , де А – це стала, яка залежить від зарядів іонів, температури та діелектричної проникності розчинів. Поняття про іонну силу розчину ввели Г. Люїс та Рендель. Згідно із законом іонної сили коефіцієнт активності в розбавлених розчинах залежить не від природи електроліту, а тільки від величини іонної сили розчину. У різних електролітів із однаковими значеннями іонної сили коефіцієнти активності будуть однакові.
, де А – це стала, яка залежить від зарядів іонів, температури та діелектричної проникності розчинів. Поняття про іонну силу розчину ввели Г. Люїс та Рендель. Згідно із законом іонної сили коефіцієнт активності в розбавлених розчинах залежить не від природи електроліту, а тільки від величини іонної сили розчину. У різних електролітів із однаковими значеннями іонної сили коефіцієнти активності будуть однакові.
Величина іонної сили І визначається як напівсуха добутків концентрацій іонів С на квадрати їх валентностей z:
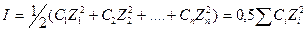
Теорія розчинів електролітів розвивається і у наш час.
В аналітичній хімії більшість хімічних реакцій проводять у розчинах. Для вираження вмісту аналізованої речовини у розчинах використовують поняття концентрації. Концентрація – це величина, яка характеризує вміст речовини у певному об’ємі її розчину. Виділяють моляльну, молярну, нормальну концентрації. Але найчастіше в аналітичній хімії використовують нормальну концентрацію (нормальність). Вона показує скільки еквівалентів речовини міститься в 1 л. розчину. Широке використання нормальності пов’язано із використанням її у розрахунках титраметричного аналізу.
3.Конспект уроку на тему «Електролітична дисоціація»
|
|
|
|
|
Дата добавления: 2015-07-02; Просмотров: 624; Нарушение авторских прав?; Мы поможем в написании вашей работы!