
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Максимальная работа при обратимых процессах
|
|
|
|
Работа химической реакции, протекающей при постоянном давлении и температуре, как следует из п.2.1.4, равна убыли потенциала Гиббса. Изменение потенциала G принято относить к такому числу молей
расходуемых исходных веществ и получаемых продуктов реакции, которое задано стехиометрическими коэффициентами. Иными словами, изменение G определяется как результат того, что в системе изменился мольный состав веществ. Считая все эти вещества идеальными газами, нужно найти изменение потенциала Гиббса системы. Например, для реакции
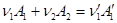
изменение потенциала

Воспользуемся теперь формулой для химического потенциала идеального
газа, чтобы выделить зависимость G от давления
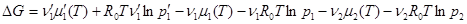
Обозначая через
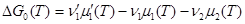 ,
,
представим эту формулу (7.15) в виде
 . (2.4.4)
. (2.4.4)
Здесь величина DG зависит только от температуры Т.
Чтобы выяснить смысл DG рассмотрим случай, когда в системе установилось химическое равновесие. Соответствующие парциальные давления будем обозначать с чертой над р:  . При равновесии DG = 0, а, следовательно,
. При равновесии DG = 0, а, следовательно,
 . (2.4.5)
. (2.4.5)
Так как при равновесии DG 0 зависит только от температуры, то и выражение, стоящее под знаком ln, зависит только от температуры. Величина справа в формуле (2.4.5) представляет собой константу химического равновесия. Следовательно,
 . (2.4.6)
. (2.4.6)
Подставляя (2.4.6) в уравнение (2.4.4), найдем, что
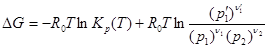 .
.
Работа химической реакции равна убыли потенциала Гиббса, или,
иными словами,

 . (2.4.7)
. (2.4.7)
Если рассмотреть химическую реакцию, протекающую в постоянном объеме (v = const), то для максимальной работы процесса получим следующую формулу
 (2.4.8)
(2.4.8)
где  - концентрации продуктов реакции и реагирующих веществ
- концентрации продуктов реакции и реагирующих веществ
|
|
|
соответственно.
Формулы, аналогичные (2.4.7), (2.4.8) используют для анализа направленности реакций при различных начальных парциальных давлениях или концентрациях. Если L>0, то реакция идет в прямом направлении, а если L<0, то реакция идет в обратном направлении. Когда L=0, имеет место равновесие. Выражение константы равновесия через давления или концентрации позволяет решать практически важную задачу - определять содержание продуктов реакции и исходных веществ в смеси,
достигшей состояния химического равновесия.
В свою очередь знание равновесного и исходного составов реакционной смеси дает возможность рассчитать:
- 1.максимально возможную степень превращения исходного вещества
в данной химической реакции, как отношение количества вещества,
вступившего в реакцию, к его количеству в исходной смеси;
- 2.равновесный выход продуктов реакции, т.е. максимальное количество этих продуктов, которое можно получить из определенного количества исходной смеси известного состава при данных условиях осуществления реакции.
Формулу (2.4.3) для константы химического равновесия можно применять, когда кроме газов есть твердые и жидкие вещества. В этом случае в формулу входят парциальные давления насыщенных паров конденсированных фаз. Парциальное давление насыщенного пара, как известно, является функцией только температуры и не зависит от парциальных давлений других газов или паров. Поэтому для удобства расчетов эти давления включают в состав константы равновесия. Соответственно в правой части уравнений этим участникам соответствуют множители, равные единице. Например, для реакции горения углерода
С + О2 = СО2
константа равновесия
 .
.
Эта величина и приведена в справочнике. Иными словами, приводимые в
справочных таблицах значения констант равновесия гетерогенных реакций, включают в себя давления паров конденсированных веществ.
|
|
|
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 342; Нарушение авторских прав?; Мы поможем в написании вашей работы!