
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакції аніонів I аналітичної групи
|
|
|
|
ЯКІСНИЙ АНАЛІЗ НЕОРГАНІЧНИХ АНІОНІВ
На відміну від катіонів аніони не заважають виявленню один одного. Тому для виявлення аніонів використовують в основному дробні реакції. Реакції розділення застосовують лише тоді, коли виявленню одного аніона заважають інші. Аніони поділяють на групи. Найпоширенішою є класифікація, що базується на різній розчинності солей барію та срібла у воді та кислотах. До першої групи відносять аніони солі барію яких погано розчинні у воді: SO42-, CO32-, PO43- та інші.
До другої групи відносять аніони, солі срібла яких є малорозчинними у воді та розведеній азотній кислоті: Cl-, Br-, I-. До третьої групи аніонів відносять іони, які утворюють з іонами барію та срібла легко розчинні солі: NO3- та інші. Тому не мають групового реагенту.
Реакції сульфат-іонів SО42-
1. Дія розчинів солей барію: ВаСl2 або Ва(NОз). Сульфат-іони SО42- при взаємодії з іонами Ва2+ утворюють осад барій сульфату білого кольору:
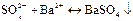
Осад ВаSО4 не розчиняється в кислотах і лугах.
2. Дія розчинів солей стронцію: SrСl3 або Sr(NОз)2. Сульфат-іони утворюють з іонами Sr2+ білий осад стронцій сульфату SrSО4, який подібно до осаду ВаSО4 не розчиняється в сильних кислотах та лугах:

3. Дія свинець нітрату Pb(NО3)2 Сульфат-іони утворюють з іонами свинцю Рb2+ білий осад свинець сульфату РbSО4:
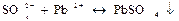
Осад РbSО4 розчиняється в лугах, амоній ацетаті та амоній тартраті внаслідок утворення стійких комплексів свинцю.
Реакції карбонат-іонів СО32-
Дія солей барію ВаСl2 або Ва(NОз)2. Іони Ва2+ осаджують іони СО32- у вигляді білого осаду ВаСО3:
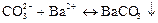
Осад ВаСОз розчиняється в оцтовій кислоті СНзСООН і в розведених cильних кислотах.
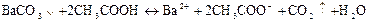

Дія розведених сильних кислот. При дії кислот карбонат-іони утворюють нестійку карбонатну кислоту, яка розкладається з виділенням бульбашок вуглекислого газу (діоксиду вуглецю) СО2:
|
|
|
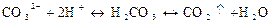
При пропусканні СО2 через вапняну або баритову воду утворюється білий осад карбонатів кальцію СаСО3 чи ВаСО3:
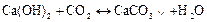
Реакції заважають тіосульфат S2О32- і сульфіт SО32- - іони, які при дії мінеральних кислот виділяють сірчистий газ, який при поглинанні у вапняну чи баритову воду також утворює білий осад:
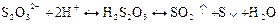
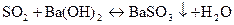
Тому спочатку виявляють присутність іонів сульфіту і тіосульфату. Якщо ці іони присутні в розчині, то перед виявленням карбонат-іонів їх окиснюють у сульфат-іони пероксидом водню Н2О2:
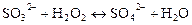
Переконавшись, що сульфіт і тіосульфат-іони окиснені повністю, виявляють карбонат-іони дією кислот.
Дія срібло нітрату АgNО3. Іони срібла Аg+ осаджують білий осад срібло карбонату АgСО3:
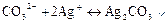
Осад Аg2СО3 при нагріванні, а також при надлишку АgNOз, переходить в осад коричневого кольору внаслідок утворення коричневого осаду срібло оксиду:

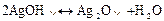
Реакції фосфат-іонів РО43-
Дія солей барію ВаСl2 або Ва(NОз)2. Іони Ва2+ осаджують фосфат-іони в нейтральному розчині з утворенням білого осаду ВаНРO4, в лужному середовищі випадає білий осад Ва3(РО4)2:

Осади ВаНРО4 і Ва3(РО4)2 розчиняються в оцтовій і мінеральних кислотах:


|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 859; Нарушение авторских прав?; Мы поможем в написании вашей работы!