
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторна робота № 13 Комплексонометричне визначення загальної жорсткості води
|
|
|
|
Контрольні питання.
1.Суть метода визначення цинку комплексонометричним методом.
2. Обчисліть масу наважки вихідної речовини.
3. Який механізм дії індикатора ксиленолового оранжевого?
4. Напишіть рівняння реакції визначення цинку комплексонометричним методом.
5. Як обчислити вміст цинка в досліджуваному розчині?
Мета: Визначити загальну жорсткість водопровідної води комплексонометричним методом.
Обладнання та посуд:.
1.Бюретка, 50,0 мл;
2.Колба для титрування;
3. Титрований розчин трилону Б, 0,1 н;
4.Мірний циліндр, 25мл;
5. Амонійний буферний розчин (рН=10)
6. Індикатор – хромоген-чорний.
Завдання: Обчислити загальну жорсткість водопровідної води.
Принцип методу. Жорсткість води – це природна властивість води, що залежить від розчинних солей кальцію та магнію.
Жорсткість, обумовлену присутністю солями кальцію, називають кальцієвою, а та що залежить від магнію – магнієвою. Сумарний склад солей кальцію та магнію називають загальною жорсткістю води. Загальна твердість поділяється на карбонатну, зумовлену складом гідрокарбонатів (при рН>8,3) солей кальцію та магнію та не карбонатну, зумовлену складом солей кальцію та магнію сильних килот. Так як при кип’ятіннні води гідрокарбонати переходять в карбонати, та випадають в осад цю твердість води називають тимчасовою. Постійна твердість залишається після кип’ятіння. Твердість пом’якшеної води виражають в мг-екв/л.
Твердість знаходиться в широких межах. Вода з твердістю менше 4 мг-екв/л називається м’якою, від 4 до 8 мг-екв/л – середньою, та від 8 до 12 мг-екв/л– досить твердою.
Висока твердість зумовлена солями магнію погіршує властивості води, надає їй гіркий смак. Загальна твердість питної води не повинна перевищувати 10 мг-екв/л. Для зменшення твердості води використовують осадження солей кальцію та магнію у вигляді малорозчинних сполук, а також використовують іоніти.
|
|
|
Загальну твердість води визначають комплексонометричнм титруванням стандартним розчином комплексну III (динатрової солі етилендиамінтетраацетату) в лужному середовищі в присутності відповідного метало індикатора (хромоген чорного, кислотного хромтимоген синього).
Комплексон III утворює в лужному середовищі безбарвні комплексні сполуки, що є більш стійкими ніж комплекси металів з метало індикатором.
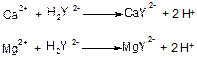
Взаємодія кальцію та магнію з хромоген чорним призводить до утворення червоно-фіолетового комплексу, який при додаванні титр анту вивільнюється з утворенням вільного індикатору, що має блакитне забарвлення. Точка еквівалентності фіксується при зміні забарвлення з червоно-фіолетового до блакитного. 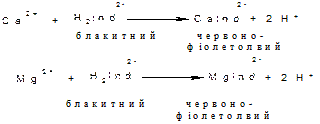
Виявленню заважають йони заліза, кобальту, алюмінію, цинку, марганцю, органічні забарвлені речовини.
Хід аналізу. До 100 мл водопровідної води додають 15 мл амонійного буферного розчину з рН 10, на кінчику лопатки порошкового індикатора хромоген-чорного та титрують 0,1 н. розчином трилону Б та спостерігають за переходом забарвлення від червоно-фіолетового до блакитного.
Загальну жорсткість визначають за формулою
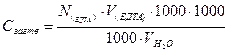
NЕДТА – нормальність ЕДТА, моль-екв/л
VЕДТА – об’єм ЕДТА, що пішов на титрування
V – об’єм проби води, взятої для визначення.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 1629; Нарушение авторских прав?; Мы поможем в написании вашей работы!