
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изучение химического равновесия в школе начинается с 10-го кл в теме «Химические реакции». Здесь говорится о химическом равновесии и о принципах смещения хим равновесия
|
|
|
|
7. Скоростью химической реакции (СХР) называют изменение количества продукта реакции в единицу времени:
v=Dnпрод/Dt.
Часто рассматривают реакции, идущие в особых условиях:
1) в однородной, иначе говоря, в гомогенной среде (газовая смесь, раствор); в этом случае определяют объёмную СХР как изменение молярной объёмной концентрации вещества в единицу времени: v гом.= 1/V×Dnпрод/Dt = DCпрод/Dt (при V=const); гомогенные реакции могут проходить быстро, так как в газе и жидкости легко происходит взаимное перемещение частиц 2) на границе раздела фаз (гетерогенные реакции); одна из фаз может быть жидкостью или газом, другая обычно твёрдая; в гетерогенных реакциях перемещение реагентов и продуктов реакции затрудняется и они обычно идут медленно.
Скорость химических реакций зависит:
1) от природы реагентов; 2) от концентрации исходных веществ;
3) от температуры; с повышением температуры скорость большинства реакций резко возрастает, так как быстро увеличивается число частиц с высокой энергией столкновения;
4) от скорости подвода реагентов и отвода продуктов на границе фаз гетерогенной реакции; 5) от присутствия в системе некоторых нерасходуемых веществ; Химические реакции обычно идут во много стадий.
С повышением температуры число столкновений частиц увеличивается (примерно на 1% на каждые 10 градусов). Однако обычно СХР растёт значительно быстрее.Для многих реакций действует правило Вант-Гоффа -с повышением температуры на каждые 10 градусов скорости многих химических реакций увеличиваются в 2-4 раза:
v2/v1 = g (t2–t1)/10.
Число g называют температурным коэффициентом реакции Вант-Гоффа.
Энергия активации — минимальное количество энергии, которое требуется сообщить системе, чтобы произошла реакция. Термин введён Аррениусом Типичное обозначение энергии реакции Ea. Типичная энергия активации в десятки раз ниже энтальпии атомизации реагентов и даже часто заметно ниже энергии отдельной связи. Это указывает на сохранение при активации большинства связей.
|
|
|
Эти представления приводят к следующему уравнению для температурной зависимости константы скорости реакции:
k = A×e-Еакт/(R×T)или k = ln A -  .
.
Влияние катализатора сводится к снижению энергии активации
КАТАЛИЗ -изменение скорости хим. р-ции при воздействии в-в, к-рые участвуют в р-ции, но не входят в состав продуктов.Различают положительный и отрицательный катализ, в зависимости от того, ускоряет катализатор р-цию или замедляет ее.Для катализа характерно, что небольшие кол-ва катализатора ускоряют превращ. больших кол-в реагирующих в-в.Термин "катализ" введен И. Берцелиусом в 1835. При гомогенном катализе катализатор и реагирующие в-ва находятся в одной фазе в молекулярно-дисперсном состоянии. При гетерогенном катализе катализатор образует самостоят. фазу, отделенную границей раздела от фазы, в к-рой находятся реагирующие в-ва. Выделяют также гетерогенно-гомогенный катализ, при к-ром р-ция начинается на пов-сти твердого катализатора, а затем продолжается в объеме. Межфазным катализом принято называть катализ на границе двух несмешивающихся жидкостей; при этом роль катализатора состоит в переносе реагентов между фазами. Снижение E объясняется тем, что при катализе р-ция протекает по новому механизму, складывающемуся из элементарных р-ций с меньшими энергиями активации, чем некаталитич. р-ция.Формирование понятия о химической реакции начинается с самого начала изучения курса химии в школе,т.е. в 7 классе.освоение основных понятий осуществляется при изучении св-в кослорода.водорода,воды а также основных классов неорганич.соед-ний.в последующий классах продолжается формирование понятия о хим.р-ции.
|
|
|
8. Р-ры весьма распространены в природе, технике, организмах человека и животных. Еще в средние века алхимикам хорошо было известно правило “Подобное растворяется в подобном”. В описаниях хим процессов они всегда указывали конц и способы приготовления исходных р-ров. Р-рами называют гомогенные фазы, с-в и св-ва кот может изменяться в опред, часто весьма широких пределах. Все газовые смеси, включая воздушную атмосферу, являются истинными р-ми со св-ми, близкими к идеальным. Способы выражения концентрации (состава) растворов
Концентрация р-ров выражается отношением массы, числа молей или числа эквивалентов р-го в-ва, приходящегося на массу, общее кол-во молей или объем всего р-ра или только р-ля. Р-ыми в-вами при одинаковом агрегатном состоянии компонентов обычно считаются компоненты, нах в недостатке, в то время как компонент, нах в избытке, считается р-лем. При разных агрег сост-ях комп-в р-ра р-лем считается компонент, агрег состояние кот совпадает с агрег состоянием р-ра. в случае жидких р-ров твердых и газообр в-в р-лем всегда считается жидкий компонент, независимо от конц р-ных в-в, кот часто превышает 50 масс.%.1. Процентная концентрация – отношение массы растворенного вещества mв к общей массе раствора mS:
С%= 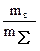 ·100%. ( 20% раствор Na2SO4 содержит 20 г Na2SO4 и 80 г H2O.)
·100%. ( 20% раствор Na2SO4 содержит 20 г Na2SO4 и 80 г H2O.)
Молярная концентрация (молярность) – число молей р-го в-ва nв, сод-ся в объёме р-ра:
СМ=М= 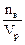 [моль/м3 или моль/л], где Vp – объём раствора, м3 или л.
[моль/м3 или моль/л], где Vp – объём раствора, м3 или л.
Пример: 1М раствор H2SO4 содержит в каждом литре 1 моль Н2SO4 или 98г.
3. Нормальная концентрация (нормальность) – число эквивалентов р-ого в-ва  , сод-ся в объёме раствора
, сод-ся в объёме раствора 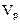 :
:
СН=Н= 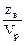 [г-экв/м3 или г-экв/л].
[г-экв/м3 или г-экв/л].
Пример: 1Н раствор H2SO4 содержит в каждом литре 1 эквивалент или 49 г Н2SO4.
4. Моляльная концентрация (моляльность) - число молей растворенного вещества nв, содержащихся в 1кг растворителя ( =1кг=1000г):
=1кг=1000г):
Сm=m= 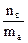 [моль/кг или моль/1000 г].
[моль/кг или моль/1000 г].
Пример: 1m водный раствор H2SO4 содержит в каждом килограмме воды 1моль Н2SO4 (или 98 г Н2SO4).
5. Мольная доля – отнош числа молей р-ого в-ва nв к общему кол-ву молей р-ра nS:
Np= 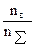 , где nS=nв+nа, где nа – число молей растворителя.
, где nS=nв+nа, где nа – число молей растворителя.
Пример: водный раствор H2SO4 с молярной долей 0,2 содержит 1 моль Н2SO4 и 4 моль H2O. Классификация растворов 1. Идеальные р-ры. Физической моделью идеального р-ра является совокупность невзаимодействующих частиц, имеющая объем, аддитивно складывающийся из объемов отд компонентов. Наиболее важными св-ми идеальных р-ров являются: а) ИР образ из чистых компонентов, нах в том же агрегатном сост, что и р-р, без теплового эффекта. б) Объем ИР, образ из чистых компонентов, нах-ся в том же агрегатном состоянии, что и р-р, аддитивно складывается из объемов отд ком-тов. Основное назначение конц-и ИР – служить эталоном, с кот сравниваются реальные р-ры. Все св-ва ИР, в отличие от реальных, легко рассчитываются исходя только из их конц-и и св-в отдельных компонентов. 2. Предельно разбавленные растворы. ПРР –р-р, в кот св-ва р-ля практически остались неизменными по сравнению с чистым р-лем ввиду низкой конц-и р-ра, в то время как св-ва р-ого в-ва могут очень сильно отличаться от его св-в в чистом виде ввиду попадания в среду р-ля. Св-ми ПРР обладают обычно все разбавленные р-ры вплоть до опред конц-и, хар-ной для каждой с-мы. Чем ближе св-ва компонентов, тем до более высокой конц-и сохраняют их р-ры св-ва ПРР. Для р-ров электролитов этот предел очень низок, т.к. ионы заметно изменяют св-ва р-ля уже при миллимолярных конц. 3. Реальные растворы. Различные св-ва РР в той или иной степени отклоняются от идеальных. Для адекватного описания этих отклонений обычно требуются различные физические модели, учитывающие межчастичные парные и коллективные взаимодействия, размеры частиц, расстояния между ними и т.д. В некоторых простейших случаях такие модели приводят к результатам, хорошо совпадающим с экспериментом. Однако наиболее универсальный и полностью формальный способ учета неидеальности ком-тов р-ра был предложен Г. Льюисом в 1907 г., кот сохранил ту же форму выражения хим потенциала компонента в РР, что и в идеальном, но вместо конц комп-та использовал в нем активности.
|
|
|
По конц р-ого в-ва р-ры можно подразделить на концентрированные (с большой конц р-ого в-ва) и разбавленные (с малой конц р-ого в-ва). Растворимость в-ва зависит от природы р-ого в-ва и р-ля, их агрег состояния, наличия в р-ре посторонних в-в, темп-ры,в случае газообр р-го в-ва – и от давления. Согласно правилу «подобное растворяется в подобном», ионные соед и молекулярные с полярным типом связи лучше р-ются в полярных р-лях, неполярные в-ва – в неполярных р-лях. При >>T растворимость газов обычно уменьшается. Растворимость тв в-в меняется по-разному, что определяется знаком теплового эффекта процесса растворения: р-е большинства тв в-в – процесс эндотерм (ΔH>0),зн.с >>T растворимость >>.
|
|
|
Формирование понятия о растворе поисходит в 8ом классе при изучении темы растворы.в которой изучается понятие о растворе.его классификация,качественные и колич.хар-ки.в этой теме ученики знакомятся с тэд.далее формирование понятия о растворах продолжается в 10 классе при изучении темы химия р-ров,здесь более углубленно изучаются понятия. Затем органика 11 кл.
10. р-ции ионного обмена- Химические реакции в растворах электролитов протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.В соответствии с правилом Бертолле: реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), малодиссоциирующее соединение (очень слабый электролит, в том числе и вода) или комплексное соединение. В таких случаях реакции будут практически не обратимы. Гидролизом называется обменная реакция веществ с водой. Гидролизу могут подвергаться соединения различных классов - соли, углеводы, белки, жиры, эфиры и т.д.В неорганической химии гидролиз солей: обменная реакция ионов соли с молекулами воды, в результате которой смещается равновесие диссоциации воды. Первое объяснение дано Аррениусом: ионы соли, которые ранее принадлежали слабым кислотам или основаниям, встречая в воде протоны или ОН-, соединяются с ними, образуя слабый электролит. Учение Вернера: вода, образуя соединения с компонентами растворенного вещества, может стать донором протонов или гидроксил-ионов. Такие соединения он назвал аквакислотами (донор протонов) или акваоснованиями (акцептор протонов).По Аррениусу гидролиз соли алюминия:
Al3++ H2O «Al(OH)2+ + H+
a по Вернеру:
[Al(H2O)6]3+ + H2O «[Al(H2O)5OH]2+ + H3O+
Здесь ион Al3+ - ангидрокислота, а [Al(H2O)6]3+ - аквакислота, отщепляющая протон.Суть во взаимодействии ионов соли с водой - гидратации. Вода - диполь. Гидратация приводит к смещению электронной плотности от воды к катиону, разрыхляется связь О-Н и отрывается протон. Явление поляризации электронных оболочек. Чем меньше катион и чем больше его положительный заряд, тем в большей степени идет процесс. Анион с водой реагирует по типу образования водородной связи, которая дестабилизирует его связь с кислородом. Анион - ангидрооснование, его гидрат - акваоснование, которое присоединяет протон.Чем больше поляризующая способность аниона или катиона, тем в большей степени идет гидролиз.
Мы пишем гидролиз по Аррениусу, т.к. это проще и не влияет на конечные количественные результаты. Но помним о его реальном механизме.Варианты гидролиза.
1) Соль образована сильным основанием и сильной кислотой - гидролизу не подвергается, рН = 7.
2)Соль образована катионом сильного основания и слабой кислотой - гидролиз по аниону.CN-+ H2O «HCN + OH- pH>7
3) Соль образована слабым основанием и сильной кислотой - гидролиз по катиону.Сu2++ H2O «CuOH+ + H+ pH<7
Обратить внимание, что пишем только первую стадию, присоединение одного гидроксила. Вторая стадия не идет, т.к. накопление протонов смещает равновесие влево.
4) Соль образована слабым основанием и слабой кислотой
Al(CH3COO)3
Al3+ + 3CH3COO- + 3H2O «Al(OH)3 + 3CH3COOH
Гидролиз по катиону и аниону одновременно идет до конца, ацетат алюминия в растворе не существует, выпадает осадок гидроокиси. рН»7 и определяется тем, что сильнее - кислота или основание.Гидролиз - обратимый, равновесный процесс, следовательно для гидролиза, например, цианида калия можно записать:
CN-+ H2O «HCN + OH-
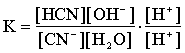
Домножив числитель и знаменатель на концентрацию протонов и введя постоянную концентрацию воды в константу, получим:

Чем слабее кислота (чем меньше Ка), тем сильнее идет гидролиз.
Легко показать, что для гидролиза по катиону Kh= KW/Kb, где Kb - константа диссоциации слабого основания, а для гидролиза и по катиону и по аниону Kh= Kw/Ka×Kb.Введем степень гидролиза, как отношение прогидролизовавшихся ионов к общему числу ионов:
h=Ch/C, тогда
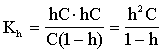
Смещение равновесия.
1) Добавление одноименных ионов. [H+] подавляет гидролиз по катиону, [OH-] подавляет гидролиз по аниону.
2) Из формулы для h видно, что разбавление способствует гидролизу.
3) Гидролиз - реакция, обратная нейтрализации. Нейтрализация - экзотермический процесс. H++ OH- = H2O DH=-56 кДж, сл-но гидролиз - процесс эндотермический. Повышение температуры способствует гидролизу. Гидролиз солей тяжелых металлов.
BiCl3 + H2O «Bi(OH)2Cl + 2HCl
Bi(OH)2Cl ®BiOCl + H2O. Образуются катионы ВiO+, выпадает белый кристаллический осадок.
Изучение понятия о реакциях ионного обмена начинается в 8ом классе в теме растворы.затем продолжается формирование и совершенствование знаний и развитие далнейшего представления о раекциях ионного обмена в последующих классах.
11. ОВР- Р-ции, в кот происходит изменение степеней окисления атомов элементов, вход в с-в реаг соед.В ОВР электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов - окисление. При окислении степень окисления повышается, Процесс присоед электронов - восстановление: При восстановлении степень окисления понижается.Атомы или ионы, кот в данной р-ции присоед электроны являются окислителями,кот отдают электроны - восстановителями. Соед, содержащие атомы элементов с макс ст окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Макс ст ок-ния атома элемента равна номеру группы в таблице, к кот относится данный элемент. Соед, сод-е атомы элементов с мин ст ок-я могут служить только восстановителями, т.к. они способны лишь отдавать электроны, потому, что вн энерг уровень у таких атомов завершен восемью электронами. Мин ст ок-я у атомов металлов равна 0, для неметаллов - (n–8) (n- номер группы в периодической системе). Соед, сод-е атомы элементов с промеж ст ок-я, могут быть и ок-ми и вос-ми, в зав-ти от партнера, с кот взаимодействуют и от условий р-ции.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 411; Нарушение авторских прав?; Мы поможем в написании вашей работы!