
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды азота, их строение общая характеристика. 3 страница
|
|
|
|
Галогенирование (присоединение галогенов) Присоединение галогенов к алкенам происходит гладко в обычных условиях. При этом образуются маслянистые дигалогеналканы, что дало повод назвать алкены олефинами. Быстрое обесцвечивание коричневой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи. Реакции присоединения галогенов при обычных условиях протекают по механизму электрофильного присоединения (АЕ). Гидрогалогенирование (присоединение галогеноводородов) Галогеноводороды также гладко присоединяются к алкенам; легче всего реагирует йодоводород (HI), несколько труднее бромоводород (HBr) и, наконец, хлороводород (HCl); для его присоединения требуется более высокая температура. Реакция идет по механизму электрофильного присоединения (AE). Электрофилом в данном случае является протон Н+ в составе молекулы галогеноводорода. Гидратация (присоединение воды) Вода присоединяется к алкенам в присутствии кислот (катализаторы) по механизму электрофильного присоединения AE:
Полимеризация алкенов 1. Полимеризация – реакция образования полимеров – соединений, молекулы которых состоят из большого числа повторяющихся звеньев. В случае полимеризации алкенов реакция протекает как цепной процесс. Наибольшее значение имеют полиэтилен, полипропилен которые образуются путѐм полимеризации этилена ил пропилена. Реакции окисления алкенов 1. Окисление алкенов водным щелочным раствором перманганата калия приводит к образованию двухатомных спиртов – гликолей. При добавлении раствора перманганата к алкену происходит выпадение бурого осадка оксида марганца (IV). 2. При более жестком окислении алкенов раствором KMnO4 в кислой среде происходит полный разрыв двойной связи; при этом образуются карбоновые кислоты и осадок оксида марганца не выпадает. Озонолиз. Алкены взаимодействуют с озоном, образуя продукты присоединения – озониды, при обработке которых цинком в кислой среде молекула расщепляется с образованием карбонильных соединений – альдегидов. Полное окисление (горение): 
|
|
|
Применение. Алкены широко применяются для синтеза различных органических веществ: спиртов, галоидпроизводных, гомологов бензола, в качестве мономеров для производства высокомолекулярных соединений.
Методика 10класс Цель урока: Обобщить и систематизировать знания по теме, осуществить контроль за качеством усвоения основополагающих вопросов, создать на уроке атмосферу поиска и успешности. Задачи: Обучающие: Проверить глубину, прочность и осознанность полученных знаний об алкенах.Повторить строение, изомерию и номенклатуру, свойства, получение и применение в промышленности.Закрепить представление о связи между строением, свойствами и областями применения
Развивающие: Развивать у учащихся познавательный интерес и творческие способности. Способствовать развитию умений классифицировать и обобщать изучаемые строения и свойства. Иллюстрировать уравнения химических реакций.Приобщать учащихся к исследовательской работе.
Воспитательные: Формировать интерес к учению.Содействовать развитию воли учащихся, создавая на уроке особое эмоциональное состояние: ситуации проблемности, занимательности, интереса.
Межпредметных нет Основные понятия: • Алкены. Непредельные Ув. Гомологический ряд. Гомологи
29. Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле СnН2n-2.
В зависимости от взаимного расположения двойных связей различают три вида диенов: • алкадиены с кумулированным расположением двойных связей
СН2=С=СН2 • алкадиены с сопряженными двойными связями
CH2=CH—CH=CH2 • алкадиены с изолированными двойными связямиCH2=CH—CH2—CH=CH2 Эти три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода в алкадиенах с кумулированными связями находится в состоянии sр-гибридизации.
Свойства алкадиенов с изолированными двойными связями практически ничем не отличаются от свойств алкенов, разве что алкадиены вступают в соответствующие реакции в две ступени. Атомы углерода, образующие двойные связи, находятся в sр2-гибридизации. Изомерия и номенклатура Для алкадиенов характерна как структурная изомерия, так и цис-транс-изомерия. Структурная изомерия: • изомерия углеродного скелета:
|
|
|
Алкадиены изомерны соединениям классов алкинов и цик-лоалкенов При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать обе кратные связи. Получение 1. Метод Лебедева. В основе метода лежит реакция
2СН3—СН2—ОН -----------------> СН9=СН-СН=СН9 + 2Н2O + Н2
2. Способ дегидрирования. Одним из самых распространенных способов получения бутадиена-1,3 является двухстадийное каталитическое дегидрирование н -бутана:
СН3—СН2—СН2—СН3 —> CH2=CH—СН=СН2 + 2Н2
3. Способ дегидрогалогенирования. Для получения алкадиенов можно применять стандартный способ создания кратных связей. При действии на дибромалканы спиртового раствора щелочи происходит отщепление двух молекул галогеноводорода и образование двух двойных связей:
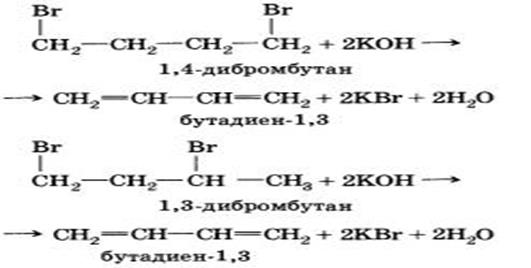
Химические свойства Алкадиены с сопряженными связями обладают некоторыми особенностями. 1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.Особенностью присоединения к алкадиенам с сопряженными двойными связями является способность присоединять молекулы как в положения 1 и 2 (1,2-присоединение), так и в положения 1 и 4 (1,4-присоединение):
Вr Вr
| |
СН2=СН—СН=СН2 + Вг2 —> CH2—CH—CH=CH2
1,2-присоединение
Вг Вг
| l
CH2=CH—СН=СН2 + Вг2 —> CH2—CH=CH—CH2
1,4-присоединение
2. Реакции полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой получения синтетических каучуков.
В этом случае двойная связь оказывается центральной в элементарном звене, а элементарное звено, в свою очередь, может принимать как цис-, так и тракс-конфигурацию:

|
|
|
Натуральный и синтетический каучуки. Резина До конца 1930-х гг. в промышленности использовали натуральный каучук, выделяемый из млечного сока (латекса) некоторых растений-каучуконосов. Исследования показали, что натуральный каучук представляет собой цис-полиизопрен, т. е. полимер, элементарные звенья которого соответствуют изопрену (2-метилбутадиену-1,3) и находятся в цис-конфигурации. Каучук, в котором все элементарные звенья находятся или в цис-, или в транс-конфигурации, называется стереорегулярным. Натуральный каучук обладает уникальным комплексом свойств: высокой текучестью, устойчивостью к износу, клейкостью, водо- и газонепроницаемостью. Для придания каучуку необходимых физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140С с серой.
Современная химическая промышленность вырабатывает несколько видов синтетического каучука. В качестве мономеров используют изопрен, бутадиен, хлоропрен (2-хлорбутадиен-1,3), стирол (винилбензол) и т. д. В настоящее время в промышленности выпускают каучук,в котором содержание звеньев изопрена, соединенных в положении 1,4, достигает 99%, тогда как в натуральном каучуке они составляют 98%. Кроме того, в промышленности получают синтетические каучуки на основе других мономеров – например, изобутилена, хлоропрена, и натуральный каучук утратил свое монопольное положение.
10 класс Цель урока: систематизировать и конкретизировать знания учащихся о непредельных углеводородах на примере алкадиенов. Задачи: Образовательные: - ознакомить с физическими свойствами и основными способами получения алкадиенов;- изучить химические свойства алкадиенов: реакции присоединения и полимеризации;- ознакомить учащихся с натуральным и синтетическим каучуком, резиной;
|
|
|
Развивающие: - способствовать развитию внимательности, усидчивости, дисциплины;- развивать самостоятельность и волю учащихся, используя поощрение настойчивости при решении заданий, устранении опеки при оказании помощи;- развивать познавательный интерес, используя данные о применении алкадиенов; Воспит: -продолжить формирование локальной химической картины мира;- содействовать в ходе урока формированию следующих мировоззренческих идей: а) обусловленность развития химической науки потребностями производства, жизни и быта; б) истинность научных знаний и законов природы;- обеспечить нравственно эстетическое воспитание. Основные понятия: алкадиены, непредельные углеводароды, гамологи изомерия
30. Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды ряда ацетилена (H-C≡C-H), молекулы которых содержат тройную связь C≡C. Общая формула алкинов СnH2n-2 Строение алкинов Ацетилен (этин) – самый простой алкин, содержащий два атома углерода, связанных тройной связью. Атомы углерода в молекуле ацетилена находятся в состоянии sp-гибридизации, все атомы лежат на одной прямой, валентные углы С-C-H равны 180o. Тройная связь образована одной σ-связью и двумя π-связями. Номенклатура алкинов По номенклатуре ИЮПАК названия алкинов строятся на основе на основе названий алканов с тем же количеством атомов углерода путем замены суффикса –ан на –ин:этан → этин; Нумерацию углеродных атомов начинают с того конца, к которому ближе тройная связь. Главная цепь обязательно должна включать в себя тройную связь Существуют также исторические названия простых алкинов, из которых широко используется только название для этина – ―ацетилен‖. Радикалы, образованные из алкинов, называются также как и в случае алкенов – путѐм добавления окончания –ил к названию алкина. Изомерия алкинов Структурная изомерия Изомерия углеродного скелета:Изомерия положения тройной связи: Межклассовая изомерия. Пространственная изомерия. Цис-транс изомерия в молекулах алкинов невозможна, т.к. заместители при тройной связи могут располагаться только одним способом – вдоль линии связи. Химические свойства Образование металлоорганических соединений – ацетиленидов Атом углерода в состоянии sp-гибридизации является более электроотрицательным по сравнению с атомом углерода в алкенах и алканах. Этим объясняется повышенная полярность связи C-H в алкинах и их большая кислотность по сравнению с алканами и алкенами. Ацетилен и его гомологи с концевой тройной связью R–C≡C–H
проявляют слабые кислотные свойства: атомы водорода могут легко отрываться под действием сильных оснований.
Реакции присоединения к алкинам. Гидрирование – присоединение водорода. Водород в присутствии катализаторов (Pt, Ni) присоединяется к алкинам с образованием алкенов. Образующиеся алкены, в свою очередь, тоже присоединяют водород, образуя алканы. Поэтому получить алкены из алкинов можно только используя специальные катализаторы Присоединение галогенов Более ненасыщенный характер алкинов заставляет предположить, что алкины будут присоединять галогены легче, чем алкины. Однако в действительности всѐ наоборот – алкины вступают в реакции присоединения труднее, чем алкены.
Алкины обесцвечивают бромную воду значительно медленнее, чем алкены. При присоединении галогенов вначале образуются дигалогеналкены, которые в свою очередь также присоединяют галоген с образованием тетрагалогеналкана. Присоединение галогенов идѐт по механизму электрофильного присоединения AE, однако в присутствии свободных радикалов может идти и по механизму радикального присоединения (AR). Гидрогалогенирование – присоединение галогеноводородов (HCl, HBr, HI) Присоединение галогеноводородов может идти по механизму электрофильного присоединения (AE). В этом случае присоединение идѐт по правилу Марковникова – водород присоединяется к более гидрогенизированному атому алкина. Если присоединение HBr вести в присутствии перекисей (R-O-O-R) то присоединение идѐт по радикальному механизму и против правила Марковникова. Присоединение HCl к ацетилену используется в промышленности для получения винилхлорида (хлорэтилена). Гидратация – присоединение воды (реакция Кучерова) Присоединение воды происходит в присутствии катализатора – сульфата ртути(II) и идет через образование неустойчивого винилового спирта, который изомеризуется в карбонильное соединение.
Другие реакции присоединения. Алкины присоединяют карбоновые кислоты в присутствии солей ртути, например, присоединение уксусная кислота присоединяется к ацетилену с образованием сложного эфира – винилацетата. Ацетилен присоединяет синильную кислоту (HCN) в водном растворе в присутствии CuCl и NH4Cl c образованием акрилонитрила. При взаимодейтсвии ацетилена с угарным газом (CO) и спиртами, образуются сложные эфиры акриловой кислоты
Полимеризация Ацетилен димеризуется под действием водно-аммиачного раствора CuCl, при этом образуется винилацетилен. Винилацетилен присоединяет HCl, образуя при этом хлоропрен из которого далее получают хлоропреновый каучук. При пропускании ацетилена через раскаленные стеклянные трубки происходит его тримеризация и образуется бензол При использовании катализаторов реакция идѐт при значительно более низкой.
Окисление алкинов Реагенты, окисляющие алкены, могут окислять и алкины. Озон, перманганат калия окисляют алкин с расщеплением тройной связи с образованием карбоновых кислот.
Применение. Применение ацетилена и его гомологов в химической промышленности многообразно и основано на реакциях, рассмотренных выше.
Методика 10 класс цель: создать условия для осознания и осмысления блока новой учебной информации, закрепить ее, проверить уровень усвоения. Задачи урока:1. Образовательные: - добиться усвоения учащимися понятий: “алкины”, “тройная связь”;- способствовать закреплению следующих понятий: “гомологи”, “гомологический ряд”, “гомологический разность”, “изомеры”;- продолжить совершенствование химического языка учащихся через использование химической терминологии и номенклатуры;- создать условия для осуществления внутрипредметных связей (на примере гибридизации);
2.Воспитательные: - продолжить развитие научного мировоззрения учащихся по средствам познаваемости мира, раскрытия закона диалектики (перехода количества в качество) на примере зависимости физических свойств алкинов от числа атомов углерода в составе;
- способствовать эстетическому воспитанию учащихся через аккуратное оформление записей на доске и в тетради;
- способствовать формированию навыков поведения учащихся в коллективном труде на примере работы в группах по моделированию;
3. Развивающие:
- способствовать развитию внимания и памяти учащихся;- развивать познавательный интерес учащихся и их наблюдательность через проведение демонстрационного эксперимента;- продолжить развитие устной речи учащихся при ответах у доски;- продолжить развитие абстрактного мышления учащихся (моделирование молекул алканов, алкенов, алкинов), приемов логического мышления на примере сравнения (углерод-углеродных связей в алканах, алкенах, алкинах), анализа (при выведении общей формулы алкинов), умений делать выводы (по строению алкинов).
Основные понятия алкины, гомологи, изомеры, пи-связь,
31. Характерные особенности ароматических углеводородов:
1) ароматические углеводороды (арены) –УВ,мол кот содержат одно или неск бензольных колец: а) бензол;б) нафталин;2) простейшим представителем аром УВ явл-ся бензол–С6Н6; 3) структурная формула бензольного ядра с черед-ся тремя дв и тремя простыми связями была предложена в 1865 г.;4) известны аром УВ с кратными связями в боковых цепях-стирол,также многояд,кот содержат неск бензольных ядер (нафталин). 2 Строение ароматических углеводородов:
| SP2 –гибридизация: Плоское тригональное строениеУгол – HCH - 120°Связи σ, πВ бензоле нет простых и дв связей, под влиянием единой π – электронной с-мы расстояние между центрами ат С становится одинаковым – 0,139 нм, все связи полуторные |
Каждый ат С в мол бензола нах-ся в сост sp2-гибридиз.Он связан с двумя соседними ат С и ат Н тремя σ -связями.В рез-те образ плоский шестиугольник,где все6 ат С и все σ -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o).π -Электронное облако обусловл сокращение расстояния между ат С.В мол бензола они одинаковы и равны 0,139 нм.В случае простой и дв связи эти расстояния составили бы соотв 0,154 и 0,134 нм.
Электронное стр-е нафталина сходно со стр-ем бензола.Его мол плоская. Дипольный момент=нулю,но электронная плотность распределена не так равномерно,как в мол бензола.Длина связей в мол нафталина разная. Мол нафталина представл 10-p-электронную с-му; электронная плотность у a-ат С выше,чем у р-ат. Нафталин обладает меньшей ароматичностью, чем бензол. Формула нафталина:
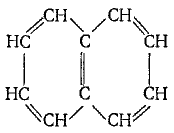 Аром явл-ся мол,подчин правилу Хюккеля: аром явл-ся плоская моноциклическая сопряж с-ма,сод(4n + 2)π-электронов (где n = 0,1,2…).правило выводится непоср из квантово-хим вычислений МОХ. Хим св-ва бензола.
Аром явл-ся мол,подчин правилу Хюккеля: аром явл-ся плоская моноциклическая сопряж с-ма,сод(4n + 2)π-электронов (где n = 0,1,2…).правило выводится непоср из квантово-хим вычислений МОХ. Хим св-ва бензола.
Галагенирования:С6Н6 + Сl2=С6Н5Сl + НСl; нитрованее: С6Н6+НО-NO2=(H2SO4 kat) C6H5NO2 + H2O; алкелирование-замещ ат Н в бенз кольце на УВ-радикал: С6Н6 + CH3Cl=(AlCl3) C6H6CH3(телуол) + HCl Реакции присоединения При опред усл бензол может вступать в р-ции присоед.В этих р-циях разруш аром с-ма,для их протекания требуется жесткие условия. Гидрирование: C6H6 + 3H2=(kat) C6H12; Хлорирование: C6H6+3CL2=(свет) С6Н6СL6
Реакции окисления.
а) отношение бензола к бромной воде и к перманганату калияб) горение бензола 2C6H6 + 15O2 –> 2CO2 + 6H2O
Нитрование,сульфирование
В реакциях электрофильного замещения в бензольном кольце атом водорода замещается на электрофильный реагент при сохранении ароматического характера исходного соединения:Правила ориентации при электрофильном замещении в бензольном кольце основаны на взаимном влиянии атомов в молекуле. Если в незамещенном бензоле C6H6 электронная плотность в кольце распределена равномерно, то в замещенном бензоле C6H5X под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и направление реакций электрофильного замещения. Место вступления нового заместителя определяется природой уже имеющегося заместителя. Правила ориентации: 1- заместители, имеющиеся в бензольном ядре оказывают ориентирующее действие; 2 – заместители делятся на 2 группы: ориентанты первого и второго рода. Ориентанты 1-го рода направляют замещение в орто- и пара-положения; 2-го рода – в мета.
Тема: «Введение в орг.химию. Углеводороды». 9 класс. Цели изучения темы: образ-ные:знакомство с новой темой арены; прогнозирование химических свойств на основе электронного строения; прогнозирование физических свойств на основе состава; знакомство со способами получения и применения. Воспитательные: формирование естественно-научного мировоззрения, установление причинно-следственных связей между строением в-ва и его св-вами, между св-вами и областями применения; формирование интереса к предмету; воспитание трудолюбия, нравственности, экологическое воспитание. Развивающие: развитие логич-го мышления, памяти, речи. Межпредметные связи: биология, педагогика, экология, физика. Опорные понятия: изомерия, гомология и наменклатура, сп2-гибридизация. Новые понятия: арены, бензольное кольцо, ароматическая связь.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 856; Нарушение авторских прав?; Мы поможем в написании вашей работы!