
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакционная способность веществ. Длинной формы периодической системы химических элементов
|
|
|
|
Длинной формы периодической системы химических элементов
Этапы развития химического знания. Основные понятия
КОНЦЕПЦИИ ХИМИИ И ГЕОЛОГИИ
1. Иерархическая последовательность эволюции химических знаний: учение о составе, структурная химия, учение о закономерностях химических процессов, эволюционная химия.
2. Эволюционная химия, как один из уровней химического знания, изучает самоорганизацию и саморазвитие химических систем.
3. Теоретическая основа классической химии XVIII–XIX – это атомно-молекулярное учение:
– все тела состоят из молекул;
– молекулы находятся в состоянии постоянного движения;
– между молекулами действуют силы притяжения и отталкивания.
4. Основой неклассической химии является квантовая механика.
5. Химический элемент – это атом с определённым зарядом ядра или с определённым количеством протонов в ядре. Другими словами, с современной точки зрения систематизирующим фактором периодической системы Д. И. Менделеева является заряд ядра атома (табл. 4.1).
6. Физический смысл периодического закона Менделеева был вскрыт при создании современной теории строения атома.
Таблица 4.1
Современный вариант
| Группы элементов | |||||||||||||||||||
| Iа | IIа | IIIб | IVб | Vб | VIб | VIIб | VIIIб | Iб | IIб | IIIа | IVа | Vа | VIа | VIIа | VIIIа | ||||
| H | He | ||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
| Cs | Ba | La | 58-71 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | 90-103 | Ku | Ns |
|
|
|
7. Энергия химической связи атомов в молекулах определяется
– строением электронных оболочек;
– энергией электронно-ионного взаимодействия.
8. Молекула – квантовомеханическая система, образованная в результате электромагнитного взаимодействия электронов и ядер нескольких атомов. Иначе, минимальная частица вещества, сохраняющая его свойства.
9. Виды связи атомов в молекулы: ионная (NaCl), ковалентная (O2, H2, N2), металлическая (металлы), водородная, Ван-дер-Ваальсова.
10. Полимеры – это высокомолекулярные соединения природного, синтетического или искусственного происхождения, обладающие особым комплексом физико-химических свойств, которые отличают их от низкомолекулярных соединений.
11. Мономером называется вещество, молекулы которого способны реагировать друг с другом или с молекулами других веществ с образованием полимера. Важнейшие мономеры: этилен, пропилен, изопрен, винилхлорид, стирол, фенол.
1. Реакционная способность вещества не связана с составом ядра и характером связи в нем, она определяется строением электронных оболочек атомов.
2. Высокая химическая активность характерна для элементов в столбцах № I (Li, Na, K, Rb, Cs, Fr) и № VII (F, Cl, Br, I, At).
3. Минимальная химическая активность у элементов из столбца № VIII: He, Ne, Ar, Kr, Xe, Rn. Валентность этих элементов равна 0.
4. Химическая кинетика изучает скорости химических реакций, их механизм и условия протекания.
5. Протекание экзотермического процесса при постоянном давлении сопровождается уменьшением энтальпии системы и выделением энергии.
6. Протекание эндотермического процесса при постоянном давлении сопровождается ростом энтальпии системы и поглощением энергии.
|
|
|
7. На скорость химической реакции влияют: температура, концентрации реагентов, наличие катализаторов, природа реагирующих веществ.
8. Зависимость скорости химической реакции v от концентрации реагентов A и B выражается законом действующих масс:
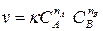 , ,
| (4.1) |
где – k константа скорости реакции, зависящая от природы реагирующих веществ; CA – концентрация реагента A; CB – концентрация реагента B; nA и nB – стехиометрические коэффициенты исходных веществ A и B в уравнении реакции.
9. Зависимость константы скорости химической реакции k от температуры выражается уравнением Аррениуса:

| (4.2) |
где A – предэкспоненциальный множитель, совпадающий по размерности с k, Ea – энергия активации, k – постоянная Больцмана, T – абсолютная температура.
10. Энергией активации называется минимальная энергия реагентов, достаточная для из вступления в химическую реакцию, то есть достаточная для преодоления барьера на поверхности потенциальной энергии, отделяющей реагенты от продуктов реакции.
11. Примеры задач.
11.1. Один моль газа при нормальных условиях занимает объём 22,4 л. Если два моля NaCl подвергли электролизу, то в результате будет получен один моль хлора объёмом 22,4 л.
11.2. Найти изменение скорости гомогенной элементарной реакции
2A(г) + B(г) A2B(г),
если давление в системе увеличится в 2 раза.
Решение: увеличение давления в 2 раза приведет к возрастанию концентраций реагентов также в 2 раза, то есть CA = 2 CA0 и CB = 2 CB0. Применим закон действующих масс. Согласно уравнению реакции nA = 2 и nB = 1, следовательно, новая скорость реакции v = k (2 CA0)2 2 CB0 = 22×2 k CA02 CB0 = 8 v0. Скорость реакции увеличится 8 раз.
12. Катализатором называется вещество, изменяющее скорость реакции или вызывающее ее, но не входящее в состав ее продуктов. Ускорение реакций достигается созданием промежуточных соединений с участием катализатора.
13. Ферментами называются биологические катализаторы, присутствующие во всех живых клетках. По химической природе – белки.
14. Направление смещения равновесия под влиянием внешних воздействий определяется принципом Ле Шателье.
14. Условием состояния равновесия является равенство скоростей прямого и обратного процессов.
|
|
|
15. Автокатализом называется ускорение реакции, обусловленное накоплением конечного или промежуточного продукта, обладающего каталитическим действием в данной реакции.
|
|
|
|
|
Дата добавления: 2015-06-27; Просмотров: 669; Нарушение авторских прав?; Мы поможем в написании вашей работы!