
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиза
|
|
|
|
Получение металлических покрытий методом
Электрохимический (гальванический) способ нанесения защит-ных металлических покрытий является в настоящее время основным методом осаждения металлов на металл. По сравнению с другими ме-тодами (диффузионным, металлотермическим, химическим и др.) он имеет ряд серьезных преимуществ: высокую экономичность, легкую управляемость процессом, возможность получения покрытий из одного и того же металла с различными механическими свойствами, сплавов разнообразного состава без применения высоких температур, хорошее сцепление покрытия с основным металлом и возможность автоматиза-ции процесса.
Основной недостаток гальванического метода − неравномерность толщины покрытия на изделиях сложного профиля и невозможность получения покрытия на крупногабаритных деталях.
Электрохимическое осаждение металлов (электролиз) проводится в гальванической ванне постоянного тока. Покрываемая деталь заве-шивается на отрицательный электрод − катод. В качестве положительного электрода − анода − служит пластина из осаждаемого
металла (растворимый анод) или из материала, не растворимого в электролите (нерастворимый, или инертный, анод). Обязательным компонентом электролитической ванны является электролит − раствор,
обладающий ионной проводимостью и содержащий простой или
комплексный ион металла, осаждаемого на катоде. В состав электролита могут входить вещества, которые повышают электропроводность раствора, обеспечивают постоянство рН, повышают поляризацию катода, способствуют получению блестящих покрытий, регулируют течение анодного процесса, а также выравнивают и другие добавки.
|
|
|
Осаждение металла происходит в результате электрохимической реакции разряда гидратированных ионов металла на катоде и вхожде-нии образовавшихся атомов в состав кристаллической решетки металла покрытия
 .
.
Одновременно на катоде может протекать побочная реакция раз-ряда гидратированных ионов водорода и выделение водорода в виде газа, который может растворяться в металле, придавая так называемую водородную хрупкость металлу покрытия и изделия (детали):
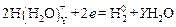 .
.
На аноде происходят процессы электрохимического растворения металла электрода (в случае растворимого анода) с образованием гид-ратированных ионов металла
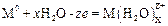
а также побочная реакция (или основная в случае нерастворимого ано-да) выделения кислорода из гидроксильных групп
 .
.
Гальваническое осаждение металла на основу протекает по стади-ям, важнейшими из которых являются:
1. Доставка разряжающихся гидратированных ионов металла из объема электролита к поверхности катода Основная движущая сила стадии − диффузия и конвекция.
2. Разряд гидратированных ионов металла на поверхности катода включая частичную или полную дегидратацию ионов и адсорбцию разрядившихся частиц (атомов) на электроде.
3. Перемещение (диффузия) атомов металла по поверхности элек-трода к местам кристаллизации (местам роста), вхождение атома в кристаллическую решетку, образование и рост кристаллических заро-дышей.
Скорость осаждения металла определяется самой медленной из перечисленных выше стадий.
Электрокристаллизация не происходит одновременно по всей по-верхности электрода, а сначала только на активных местах (местах роста). К ним относятся вершины углов и рёбер кристалла, дефекты поверхности катода. Сначала возникают кристаллические зародыши, которые растут за счет присоединения разрядившихся атомов металла.
Структура гальванического покрытия определяется соотношением скоростей образования зародышей к их роста. Чем выше скорость образования зародышей, тем более мелкозернистой формируется структура покрытия. Возникновение кристаллических зародышей связано с большой затратой энергии по сравнению с энергией их роста. Поэтому повышение катодной поляризации (сдвиг потенциала катода в отрицательную сторону) способствует получению мелкозернистых покрытий, которые обладают джигами защитными свойствами. Величина поляризации (перенапряжение) также лимитируется самой медленной стадией.
|
|
|
Структура металлического покрытия, его защитные и физико-химические свойства определяются природой осаждаемого металла, составом электролитической ванны и режимом электролиза.
В настоящее время в электролит часто добавляют поверхностно-активные вещества (ПАВ), которые повышают катодную плотность тока, что позволяет получать более плотные, мелкозернистые покры-тия, а также для лучшего блескообразования.
Повышение плотности катодного тока увеличивает катодную по-ляризацию и скорость осаждения, однако верхний предел её ограничен эффектом дендритообразования. когда скорости разряда ионов и дос-тавки их к поверхности электрода равны.
С повышением температуры возрастает верхний предельный ток, а следовательно, и верхний предел рабочей плотности тока, увеличи-вается растворимость солей, электропроводность раствора и выход по току.
|
|
|
|
|
Дата добавления: 2015-06-28; Просмотров: 406; Нарушение авторских прав?; Мы поможем в написании вашей работы!