
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные растворы
|
|
|
|
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Буферным называют раствор, рН которого не изменяется при его разбавлении или добавлении небольших объемов сильной кислоты или сильного основания.
Буферный раствор состоит из слабой кислоты и ее соли (СН3СООН-СН3ССОNa) или слабого основания и его соли (NH4OH - NH4Cl). Из слабых многоосновных кислот и их солей также можно приготовить буферные растворы, например Н3РО4 – NaH2PO4 и NaH2РО4 – Na2HPO4.
Значения рН буферного раствора, состоящего из кислоты и его соли, рассчитывают по уравнению
рН= рКНА- lg 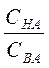 , (1)
, (1)
где СНА и СВА – молярные концентрации кислоты и соли в буферном
растворе, моль/л;
КНА – константа диссоциации кислоты, моль/л.
Из уравнения 1 следует, что значения рН буферных растворов зависиттолько от отношения общих концентраций компонентов раствора и не зависит от разбавления (в определенных пределах). При изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз, а отношение концентраций не меняется.
При условии СНА= СВА отношение 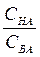 =1 и lg
=1 и lg 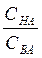 =о. То есть, рН= рКНА
=о. То есть, рН= рКНА
Для буферных растворов, состоящих из слабого основания ВОН и его соли ВА, значение рН рассчитывают по формуле
рН=14 – рКВОН + lg 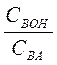 . (2)
. (2)
Величину буферного действия характеризуют с помощью буферной емкости, равной числу молярных масс эквивалента сильной кислоты или сильного основания, которое можно добавить к 1 литру буферного раствора, чтобы рН изменился на единицу.
Буферная емкость зависит от природы и общих концентраций компонентов буферного раствора, а также от соотношения их концентраций. Чем больше концентрация компонентов буферного раствора и чем ближе к единице отношение 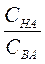 (в случае кислых буферов) и
(в случае кислых буферов) и 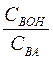 (в случае основных буферов), тем больше буферная емкость.
(в случае основных буферов), тем больше буферная емкость.
|
|
|
Буферная емкость максимальна, когда вышеприведенные отношения равны единице. Если Б – буферная емкость, а и b – число молярных масс эквивалентов соответственно кислоты (НCl) и основания (NaOH), то
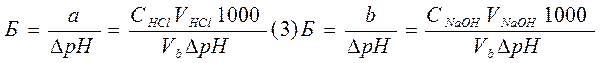 (4)
(4)
где  - изменение рН при добавлении данного количества кислоты или основания к объему (Vb) буферного раствора.
- изменение рН при добавлении данного количества кислоты или основания к объему (Vb) буферного раствора.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 2194; Нарушение авторских прав?; Мы поможем в написании вашей работы!