
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Жёсткость воды
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Природная вода в своем составе всегда содержит различные примеси- соли и газы, механические примеси, находящиеся во взвешенном состоянии, эмульсии, гидрозоли и другие коллоидные образования и т.п. Соли, присутствующие в воде, вызывают жесткость воды.
Гидрокарбонаты кальция и магния обуславливают карбонатную жесткость. При нагревании воды растворенные гидрокарбонаты разлагаются, и карбонатная жесткость при этом сильно снижается. Полного устранения карбонатной жесткости не происходит вследствие того, что карбонат кальция, и особенно магния несколько растворим в воде.
Наряду с понятием «карбонатная жесткость», существует еще понятие об устранимой жесткости, на которую она понижается при десятиминутном кипячении воды. Жесткость, оставшаяся после кипячения воды, называется постоянной жесткостью.
Хлориды и сульфаты кальция и магния обуславливают некарбонатную жесткость воды. Сумма карбонатной и некарбонатной жесткости составляет общую жесткость. Жесткость выражают в виде суммы миллимоль-эквивалентов ионов кальция и магния, содержащихся в 1 л воды. 1 ммоль-экв (ммоль/л) жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Различают очень мягкие, мягкие, средне жесткие, довольно жесткие, жесткие и очень жесткие воды. Один литр мягкой воды содержит 1,5-3,0 ммоль-экв, а жесткой 6,5-11,0 ммоль-экв Са2+.
Жесткость воды определяется аналитически.
Карбонатную (устранимую или временную) жесткость воды определяют титрованием воды соляной кислотой:
Са(НСО3)2 + 2НС1 = CaCl2 + 2H2O + 2СO2
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Точку эквивалентности можно определить или потенциометрическм титрованием с помощью рН-метра (определение объема раствора соляной кислоты в точке скачка рН) или титрованием в присутствии кислотно-основных индикаторов (чаще всего метилового-оранжевого).
Для выбора соответствующего кислотно-основного индикатора необходимо строить интегральную кривую титрования, исходя из показателей потенциометрического титрования. После определения значения рН-скачка подбирается соответствующий индикатор, исходя из его физико-химических показателей.
Таблица 1 – Характеристика наиболее часто применяемых кислотно-основных индикаторов.
| № | И н д и к а т о р | Интервал перехода рН | Изменение окраски раствора при возрастании рН |
| О-крезоловый синий | 0,2 - 1,9 | красная 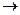 желтая желтая
| |
| Тимоловый синий | 1,2 – 2,8 | красная 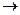 желтая желтая
| |
| Метиловый оранжевый | 3,1 – 4,4 | красная 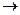 оранжевая оранжевая
| |
| Бромкрезоловый зеленый | 3,8 – 5,4 | желтая 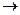 синяя синяя
| |
| Бромметиловый зеленый | 5,0 – 8,0 | желтая 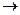 синяя синяя
| |
| Лакмус | 5,0 –8,0 | красна 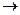 синяя синяя
| |
| Бромтимоловый синий | 6,0 – 7,6 | желтая 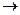 синяя синяя
| |
| Феноловый красный | 6,8 – 8,4 | желтая 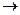 красная красная
| |
| Фенолфталеин | 8,0 – 9,6 | бесцветная  красная красная
| |
| Ализариновый желтый | 10,0 – 12,0 | бледно-лимон.  желтый желтый
|
Некарбонатную (постоянную) жесткость воды определяют методом обратного титрования. К отмеренному объему исследуемой воды добавляют определенный объем раствора карбоната натрия известной концентрации и выпаривают раствор досуха. При этом образуются нерастворимые в воде карбонаты кальция и магния.
Са2+ + Mg2+ + 2Na2CO3 = CaCO3 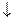 + MgCO3
+ MgCO3 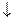 + 4Na+
+ 4Na+
Сухой остаток, представляющий из себя смесь карбонатов кальция, магния, натрия и других солей натрия, растворяют в не содержащей СО2 воде, отфильтровывают нерастворимые в воде карбонаты кальция и магния и титрометрическим способом определяют в растворе количество избыточного Na2CO3, не вошедшего в реакцию осаждения карбонатов. Специальными опытами показано, что при этом Na2CO3 не реагирует с гидрокарбонатами кальция и магния. Именно поэтому, этот метод позволяет определять постоянную жесткость воды.
|
|
Дата добавления: 2015-06-29; Просмотров: 3353; Нарушение авторских прав?; Мы поможем в написании вашей работы!