
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1: Рассчитайте общую жесткость воды (ммоль/л), если в 0,15 л воды содержится 16,2мг гидрокарбоната кальция
|
|
|
|
Задача 1: Рассчитайте общую жесткость воды (ммоль/л), если в 0,15 л воды содержится 16,2мг гидрокарбоната кальция, 2,92мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50мг хлорида магния.
Решение: Выразим общую жесткость воды как сумма милимолярных концентраций эквивалентов двухзарядных катионов металлов (или соответствующих их солей) в воде:
Жобщ = 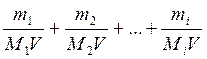 ;
;
где m1, m2, mi - массы двухзарядных катионов металлов (или соответствующих им солей) в воде, мг;
M1, M2 и Mi – миллимолярные массы эквивалентов двухзарядных катионов металлов (или соответствующих им солей) в воде, мг/ммоль;
V- объем воды, л.
Определим миллимолярные массы эквивалентов солей, обуславливающих жесткость воды:
| Соль | Са(HCО3)2 | Mg(HCО3)2 | СаCl2 | Mg Cl2 |
| М(1/2), ммоль/л | 55.5 |
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости и обуславливается содержанием в ней солей, придающих ей жесткость:
Жобщ =  = 2,56 ммоль/л
= 2,56 ммоль/л
Ответ: Жобщ = 2,56 ммоль/л
Задача 2: Найдите временную жесткость воды, если на титрование 0,1л образца воды, содержащий гидрокарбонат магния, израсходовано 7,2  10-3 л 0,14н HCl.
10-3 л 0,14н HCl.
Решение: При титровании воды соляной кислотой происходит реакция
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2
Воспользуемся уравнением (1):
Х1 =  =
= 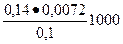 =10,08 ммоль/л
=10,08 ммоль/л
Ответ Х1 = 10,08 ммоль/л
Задача 3: Для устранения общей жесткости по известково-содовому методу добавлено 7,4г Са(ОН)2 и 5,3г Na2CO3. Рассчитать временную и постоянную жесткость воды.
Решение: Добавление к воде Са(ОН)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие реакции:
Mе(HCО3)2 + Са(ОН)2 = МеCО3  + СаCО3
+ СаCО3 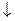 + 2Н2О
+ 2Н2О
Mе(NО3)2 + Na2CO3 = MeCO3 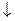 + 2NaNO3
+ 2NaNO3
(где Ме2+ = Са2+; Mg2+; Fe2+ и др.)
|
|
|
Временную жесткость воды Жвр измеряют количеством гидроксида кальция, участвующую в реакции, а постоянную жесткость Жпост- количеством карбоната натрия.
Жвр= 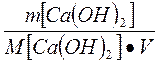 ; Жпост =
; Жпост =  ;
;
M[1/2 Са(ОН)2] = 74/2=37мг/ммоль; M(1/2 Na2CO3) = 106/2=53мг/ммоль;
Жвр = 7400/(37  50) = 4 ммоль/л;
50) = 4 ммоль/л;
Жпост = 5300/(53 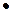 50) = 2 ммоль/л;
50) = 2 ммоль/л;
Общая жесткость воды равна: Жобщ = Жвр + Жпост = 4 + 2 = 6 ммоль/л
Ответ: Жвр = 4 ммоль/л; Жпост = 2 ммоль/л.
Варианты задач по теме 3.2 жёсткость воды
1. При определении карбонатной жесткости воды используют индикатор метилоранжевый. Почему нельзя использовать фенолфталеин?
2. Почему при кипячении воды ее временная (устранимая) жесткость уменьшается?
3. Почему карбонатная жесткость воды обусловлена гидрокарбонатами кальция и магния? Каков механизм их появления в воде?
4. Почему комплексометрическим методом определяют только общую жесткость.
5. Наличием каких растворенных солей обусловлена постоянная жесткость? Почему она так называется?
6. Что происходит при кипячении жесткой воды с гидроксидом натрия? Почему считают, что израсходованное количество NaOH эквивалентно суммарному количеству растворенных солей не карбонатного происхождения?
7. Что такое обратное титрование и как его осуществляют? Какие преимущества имеет этот метод?
8. Почему при титровании с применением индикаторов в точке эквивалентности происходит резкое изменение окраски раствора? Какие при этом соединения находятся в растворе, если для определения карбонатной жесткости анализируемую воду титруют кислотой?
9. Какой параметр при титровании раствора меняется в точке эквивалентности, и какими методами можно его фиксировать?
10. Благодаря каким свойствам трилона-Б (комплексон III) его используют в качестве титранта?
11. Поясните роль аммиачного буферного раствора при анализе?
12. Почему при прибавлении кристаллов эрихрома раствор краснеет, а в точке эквивалентности - синеет?
|
|
|
13. На титрование 100 мл воды пошло 2 мл 0,1 н. раствора трилона Б. Рассчитайте жесткость воды.
14. Вода содержит в 10л 0,95г хлорида магния и 1,62г гидрокарбоната кальция. Определить карбонатную, некарбонатную (постоянную) и общую жесткость этого образца воды.
15. Чему равна жесткость (в ммоль/л) 0,005 М раствора СаCl2?
16. Растворимость СаSO4 в воде 0,202 %. Вычислите жесткость насыщенного раствора этой соли, принимая его плотность за 1,0 г/мл.
17. Для умягчения 100л воды потребовалось 12,72г Na2CO3. Чему равна жесткость образца воды (в ммоль/л)?
18. На титрование 0,05л образца воды израсходовано 4,8 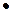 !0-3л 0,1н HCl. Чему равна карбонатная жесткость воды?
!0-3л 0,1н HCl. Чему равна карбонатная жесткость воды?
19. Какую массу гашенной извести надо прибавить в 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 ммоль/л?
20. При определении временной жесткости на титрование 0,1л воды израсходовано 5,25 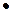 10-3л 0,101н HCl. Какая жесткость этой воды?
10-3л 0,101н HCl. Какая жесткость этой воды?
21. Образец воды объемом 1 литр содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество Са2+ и Mg2+ содержится в 1 литре этой воды? Чему равна общая, постоянная и карбонатная жесткость воды?
22. Некарбонатная жесткость воды равна 3,18 ммоль/л. Какую массу Na3РO4 надо взять, чтобы умягчить 1м3 воды?
23. Для удаления карбонатной жесткости применяют одно из следующих веществ: едкий натр, гашеную известь, тринатрийфосфат. Какое из названных веществ окажется наиболее эффективным, если взять их одинаковые количества? Ответ иллюстрируйте уравнениями реакций и соответствующими расчетами.
24. Почему для регенерации катионита его промывают раствором хлорида натрия, а затем водой? Можно ли применить для регенерации катионита раствор хлорида кальция?
25. Вода содержит 0,12 г/л растворенного гидрокарбоната кальция. Сколько нужно прибавить извести к 10 л такой воды, чтобы осадить гидрокарбонат в виде карбоната?
26. Какие группы имеются на поверхности катионитов и анионитов?
27. Почему для полного обессоливания воды необходимо применять смесь катионитов и анионитов? Почему нельзя их применять в отдельности?
28. Какую реакцию среды имеет Na-катионированная вода, Н-катионированная вода?
29. Почему при использовании реагентных методов не достигается полное удаление ионов Са2+ и Mg2+.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 33806; Нарушение авторских прав?; Мы поможем в написании вашей работы!