
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1. При синтезе аммиака N2 +3H2 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л):
|
|
|
|
Задача 1. При синтезе аммиака N2 +3H2  2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л):
2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л):
 = 2,5;
= 2,5; 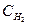 = 1,8;
= 1,8;  = 3,6. Рассчитайте константу равновесии этой реакции и исходные концентрации азота и водорода,
= 3,6. Рассчитайте константу равновесии этой реакции и исходные концентрации азота и водорода,
Решение. Определяем константу равновесия КС этой реакции:
Kc =  = (3,6)2/ 2,5 (1,8)3 = 0,89
= (3,6)2/ 2,5 (1,8)3 = 0,89
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3,, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось З,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
Сисх (Н2) = 2,5 + 1,8 = 4,3 моль/л
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, и для получения 3,6 моль аммиака требуется 3х3,6/2=5,4 моль; Сисх(Н2) = 1,8 + 5,4 = 7,2 моль/л.
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4.3 моль/л; C (H2) = 7,2 моль/л
Ответ: С(N2) = 4.3 моль/л; C (H2) = 7,2 моль/л
Задача 2. Объемный состав реакционной смеси в момент равновесия для реакции 2СО2 = 2СО+О2 был следующий: 88,72 % СО2; 7,52 % СО; 3,76 % О2. Найдите Кр для реакции, если общее давление в системе при данной температуре (2273 К) равно 1,0133 • 105 Па,
Решение. Для реакций, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальным давлениями реагирующих веществ. Константу равновесия Кр - вычисляют через парциальные давления:
Кр = 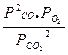
Определив парциальные давления реагирующих веществ:
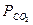 = 1,0133
= 1,0133  105
105  0,8872= 0,8990 * 105 Па;
0,8872= 0,8990 * 105 Па;
РСО =1, 0133  105•0,0752 =0,0762 * 106 Па;
105•0,0752 =0,0762 * 106 Па;
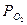 = 1,0133
= 1,0133  105
105  0,0376= 0,0381 * 105 Па,
0,0376= 0,0381 * 105 Па,
Подставив соответствующие значения парциальных давлений СО2, СО и О2 в выражение 1 получим Кр = 27,35 Па.
Ответ: Кр = 27,35 Па
Задача 3. Реакция протекает по уравнению А+В  2С. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции КС =50.
2С. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции КС =50.
|
|
|
Решение. К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через Х моль, то увеличение концентрации вещества С будет равно 2 Х моль.
Равновесные концентрации реагирующих веществ будут: СА= (0,5- х) моль/л; СВ = (0,7-х)моль/л; СС = 2х моль/л.
Кс = С2 С /САСВ = 4х2/(0,5 –х) (0,7-х) =4х2 / (0,35 – 1,2х + х2) = 50;.
Решая это уравнение, получаем: х1 = 0,86; х2 = 0,44. Так как, исходные концентрации веществ А и В были 0,5 и 0,7 моль/л соответственно, то их конверсия (превращение или расход) не может быть выше этих величин. Следовательно, по условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: СА=0,5 - 0,44 = 0,06 моль/л; СВ = 0,7- 0,44 = 0,26 моль/л; СС = 0,44  2 = 0,88 моль/л.
2 = 0,88 моль/л.
Ответ: СА= 0,06 моль/л; СВ = 0,26 моль/л; СС =0,88 моль/л.
Задача 4: Рассчитайте константу равновесия реакции
С25Н2807 + НС1  С25Н27О6С1 + Н2O
С25Н27О6С1 + Н2O
если для ее проведения смешали 12 мл 10-2М раствора С25Н2807 и 15 мл 10-2М раствора НС1. Полученную смесь разбавили водой до 50 мл. Равновесная концентрация С25Н27О6С1 оказалась равной 2,03  10-3 моль/л.
10-3 моль/л.
Решение: Вычислим количество исходных и конечных веществ до и после реакции. Известно, что количество вещества определяется как произведение молярной концентрации (моль/л) и объема раствора (в литрах). Тогда имеем:
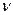 о(С25Н2807)=12
о(С25Н2807)=12  10-3
10-3  10-2=1,2
10-2=1,2  10-4моль, и
10-4моль, и 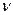 о (НСl)=15
о (НСl)=15  10-3
10-3  10-2=1,5
10-2=1,5  10-4 моль.
10-4 моль.
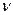 (С25Н27О6С1) = 50
(С25Н27О6С1) = 50  10-3
10-3  2,03
2,03  10-3=1,015
10-3=1,015  10-4 моль.
10-4 моль.
Если образовалось продукт, в количестве 1,015  10-4 моль, то в соответствии с реакцией, столько же было израсходовано соляной кислоты и С25Н2807. Следовательно, в равновесной смеси, концентрация исходных веществ составит: СМ(С25Н2807)=
10-4 моль, то в соответствии с реакцией, столько же было израсходовано соляной кислоты и С25Н2807. Следовательно, в равновесной смеси, концентрация исходных веществ составит: СМ(С25Н2807)= 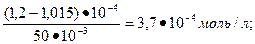 и СМ(НСl)=
и СМ(НСl)=  . Константу равновесия считаем по уравнению КС =
. Константу равновесия считаем по уравнению КС =  =
= 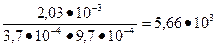
|
|
|
Ответ: 5,66 * 103
Задача 5: Константа химического равновесия реакции С2H6(г)  С2Н4(г)+ Н2(г) при 1500К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: этана - 0,06Мпа, этилена - 0,02 Мпа и водорода 0,01 МПа.
С2Н4(г)+ Н2(г) при 1500К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: этана - 0,06Мпа, этилена - 0,02 Мпа и водорода 0,01 МПа.
Решение: В этой задаче приведены парциальные давления реагирующих компонентов смеси. Поэтому, в данном случае следует пользоваться выражение Кр.
Кр= 
Как видно, расчет значения Кр по исходным показателям давления реагирующих газов дает значения, намного меньше, чем значения константы равновесия (38,4). Это означает, что в результате химических превращений, давления реагирующих газов изменились таким образом, что их отношение приводит к увеличению дроби. Такая ситуация возможна, если возраст числитель, при этом уменьшится знаменатель. То есть, в реакционной среде должно быть увеличено давление этилена и водорода, и уменьшено давление этана. Такая ситуация возможна, если в ходе реакции будет израсходован этан (знаменатель) в результате чего будут возрастать давление водорода и этилена. Это означает, что реакции направлена слева на право, то есть реакция идет в сторону разложения этана с образованием водорода и этилена.
Ответ: равновесие сдвинуто вправо.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 3239; Нарушение авторских прав?; Мы поможем в написании вашей работы!