
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические пояснения. Концентрация раствора – это относительное содержание растворенного вещества в растворе
|
|
|
|
Концентрация раствора – это относительное содержание растворенного вещества в растворе. Для выражения концентрации растворов существует два способа.
I. долевой способ:
а) массовая доля вещества ω, безразмерная величина или выражается в процентах, вычисляют по формуле
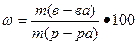 %
%
где m(в-ва), масса вещества, г;
m(р-ра), масса раствора, г.
б) мольная доля χ, величина безразмерная или выражается в процентах, вычисляют по формуле
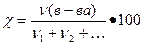 %
%
где ν(в-ва), количество вещества, моль;
ν1 + ν2 +…, сумма количеств всех веществ в растворе, моль.
в) объемная доля φ, величина безразмерная или выражается в процентах, вычисляют по формуле
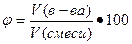 %
%
где V(в-ва), объем вещества, л;
V(смеси), объем смеси, л.
II. концентрационный способ:
а) молярная концентрация CM, моль/л, вычисляют по формуле

где ν(в-ва), количество вещества, моль;
V(р-ра), объем раствора, л.
б) нормальная концентрация СН, моль/л, вычисляют по формуле
 или
или 
где ν(экв), количество вещества эквивалента, моль;
V(р-ра), объем раствора, л;
Z, фактор эквивалентности.
в) моляльная концентрация Сb, моль/кг, вычисляют по формуле

где ν(в-ва), количество вещества, моль;
m(р-ля), масса растворителя, кг.
г) титр Т, г/мл, вычисляют по формуле

где m(в-ва), масса вещества, г;
V(р-ра), объем раствора, мл.
Поскольку растворы это физико-химические системы необходимо рассмотреть процесс взаимодействия растворенного вещества с водой.
При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей. Поэтому удобно прибегнуть к некоторой идеализированной модели раствора. Такой раствор, образование которого не связано с тепловым эффектом и с изменением объема называют идеальным раствором.
|
|
|
Хотя большинство растворов и не обладает в полной мере свойствами идеальных, однако свойства многих из них могут быть описаны при помощи этой модели. Наиболее подходящими в этом плане являются разбавленные растворы, в которых содержание растворенного вещества очень мало по сравнению с содержанием растворителя.
Рассмотрим свойства разбавленных растворов, которые зависят от числа частиц растворенного вещества и от количества растворителя, но практически не зависят от природы растворенных частиц (коллигативные свойства).
К таким свойствам относятся: понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания раствора по сравнению с чистым растворителем, осмотическое давление.
Осмос - это односторонняя диффузия веществ из растворов через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора различной концентрации.
В системе растворитель-раствор молекулы растворителя могут перемещаться через перегородку в обоих направлениях. Но число молекул растворителя, переходящих в раствор в единицу времени, больше числа молекул, перемещающихся из раствора в растворитель.
Давление, которое надо приложить, чтобы скорости обоих процессов были равными, называют осмотическим.
Растворы, характеризующиеся одинаковым осмотическим давлением, называются изотоническими.
Осмотическое давление определяют согласно закону Вант - Гоффа
 ,
,
где ν, количество вещества, моль;
R, газовая постоянная, равная 8,314 Дж/(моль·К);
Т, абсолютная температура, К;
V, объем раствора, м3
Согласно закону Рауля, относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного нелетучего вещества:

Повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем, по следствию из закона Рауля прямо пропорциональны моляльной концентрации растворенного вещества:
|
|
|

где  - изменение температуры,
- изменение температуры, 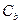 - моляльная концентрация (моль/кг),
- моляльная концентрация (моль/кг),  - коэффициент пропорциональности, в случае повышения температуры кипения называется эбулиоскопической константой, а для понижения температуры замерзания – криоскопической. Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль нелетучего электролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и понижением температуры замерзания раствора. Криоскопические и эбулиоскопические константы не зависят от природы растворенного вещества, а лишь зависят от природы растворителя и характеризуются размерность
- коэффициент пропорциональности, в случае повышения температуры кипения называется эбулиоскопической константой, а для понижения температуры замерзания – криоскопической. Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль нелетучего электролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и понижением температуры замерзания раствора. Криоскопические и эбулиоскопические константы не зависят от природы растворенного вещества, а лишь зависят от природы растворителя и характеризуются размерность  .
.
| Растворитель | Температура, 0С | Константа, 
| ||
| Кипения | Плавления | 
| 
| |
| Н2О | 0,52 | 1,86 | ||
| С6Н6 | 80,1 | 5,5 | 2,53 | 5,12 |
| ССI4 | 76,5 | -22 | 5,03 | 30,0 |
| СНСI3 | 61,7 | -63,5 | 3,63 | 4,7 |
Выше приведены криоскопические  и эбулиоскопические
и эбулиоскопические  константы для некоторых растворителей:
константы для некоторых растворителей:
Криоскопия и эбулиоскопия – методы определения молекулярных масс растворенных веществ. Эти методы позволяют определить молекулярную массу не диссоциирующих при растворении веществ по понижению температуры замерзания и по повышению температуры кипения растворов известной концентрации:
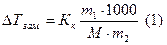
где  - масса растворенного вещества в граммах,
- масса растворенного вещества в граммах, 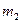 - масса растворителя в граммах,
- масса растворителя в граммах, 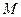 - молярная масса растворенного вещества в г/моль, 1000- коэффициент пересчета от граммов растворителя к килограммам. Из (1) молярная масса неэлектролита выразится как:
- молярная масса растворенного вещества в г/моль, 1000- коэффициент пересчета от граммов растворителя к килограммам. Из (1) молярная масса неэлектролита выразится как:

Растворимость S показывает, сколько граммов вещества может раствориться в 100 г воды при данной температуре. Растворимость твердых веществ с ростом температуры, как правило, возрастает, а для газообразных веществ - уменьшается.
Твердые вещества характеризуются самой различной растворимостью. Наряду с растворимыми веществами существуют малорастворимые и практически нерастворимые (в воде). Однако абсолютно нерастворимых веществ в природе нет. Рассмотрим равновесие между твердым осадком труднорастворимой соли AgCI и ее ионами в растворе:
|
|
|
AgCl(тв) = Ag+ + Clˉ
Константа равновесия имеет вид
K=[Ag+] [Clˉ].
При этом концентрация конденсированной фазы [AgCl(тв)] как постоянная входит в величину К. Тогда константа равновесия определяется только произведением концентраций ионов [Ag+] и [Clˉ] в растворе и называется произведением растворимости:
ПР=[Ag+] [Clˉ].
Для соединения АmBn
ПР= [А+]m [Bˉ]n
Величина ПР характеризует растворимость труднорастворимого электролита при постоянной температуре.
Следует различить понятия произведение растворимости(ПР) и произведение ионов (ПИ).
ПР, величина постоянная и показывает какое значение имеет произведение молярных концентраций ионов, образующиеся при диссоциации слабо растворимого вещества в насыщенном этим веществом растворе (водный раствор, содержащий осадок этого вещества).
ПИ это ионное произведение концентраций ионов в любом, искусственно созданном (не насыщенном) растворе. Если значение ПИ > ПР, то образуется осадок мало растворимого вещества.
Пользуясь значениями ПР, можно рассчитать молярную концентрацию ионов в насыщенном растворе. Сопоставлением значений ПР и ПИ можно предсказать, выпадет ли осадок, при смешении двух растворов с определенными концентрациями и объемами?
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 581; Нарушение авторских прав?; Мы поможем в написании вашей работы!