
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы в природе. Теории растворов
|
|
|
|
Растворы
Применение
Некоторые лекарственные препараты применяются в коллоидной форме. Препараты серебра (прошаргол, колларгол) используются в медицине исключительно в коллоидной форме. Введение в организм лекарства в каллоидной форме локализует его действие и увеличивает срок его действия на больной орган, так как такое вещество выводится из тканей организма гораздо медленнее, чем, если бы оно было введено в виде обычного раствора.
Растворы в природе и жизнедеятельности играют огромную роль. Воздух (загрязненный) - N2, О2, СО2 и другие вещества, морская вода – Н2О + Nа+, Мg2+, СГ, S042- и т.д. Человеческий организм содержит множество различных растворов; простые растворы солей и кислот; сложная дисперсия - кровь. Растворы могут существовать в любом агрегатном состоянии, но обязательно состоят из одной фазы. Естественно, что на разных этапах развития человечества проблема познания природы растворов решалась разными способами. Первый этап в познании природы растворов нашел отражение в философских высказываниях древних греков, второй - в работах алхимиков средних веков, третий - в работах Д. И. Менделеева и его последователей.
Нельзя не согласиться с известным историком химии П. Вальденом, который утверждал, что на протяжении многих веков история химии является историей вопроса о природе растворов, ибо основные реакции протекают именно в растворах. В средние века родился известный лозунг алхимиков "Соrроrа nisi soluta non аgunt" ("Только растворенные вещества взаимодействуют"). В настоящее время большинство химических реакций - это реакции в растворах, поэтому познание природы растворов необходимо с научной и практической точки зрения.
|
|
|
Во второй половине XIX в. в науке существовало две точки зрения на природу растворов. Согласно первой раствор уподоблялся газовой смеси, то есть растворитель и растворенное вещество, образуя раствор, не меняют своей природы (физическая теория). Вторые считали раствор химическим соединением (химическая теория). Имелась и промежуточная теория. Так, Г. И. Гесс полагал, что те растворы, из которых после испарения растворителя выделяется вещество, не содержащее молекул растворителя (вода), принадлежат к группе так называемых физических растворов, а растворы, из которых кристаллизуются кристаллосольваты (кристаллогидраты) являются химическими соединениями.
Д. И. Менделеев для выработки единой точки зрения на природу растворов применил метод исключения. Чтобы исключить химическую теорию, он указал на неприменимость к растворам законов постоянства состава и кратных отношений. Для доказательства несостоятельности физической теории он использовал собственные экспериментальные данные и результаты исследования других ученых. Изучая спиртоводные смеси и плотности растворов вообще, он сформулировал важный тезис: объемы растворов не являются аддитивными величинами по отношению к объемам растворителя и растворенного вещества. Он также указал на факт изменения окраски раствора по сравнению с окраской растворителя и растворенного вещества, что указывало на какие-то существенные изменения, происходящие в природе вещества при его растворении. Физическая теория не могла объяснить эти факты. Но самое существенное доказательство неправомочности физической теории на растворы - это сам процесс растворения. Как можно понять растворение вещества, если не предположить взаимодействия растворителя с растворенным веществом? Для того чтобы растворить кристалл, надо разрушить его кристаллическую решетку, а для этого необходима энергия. Откуда берется эта энергия, если не в результате взаимодействия веществ? Для создания своей концепции Д. И. Менделеев использовал работы Сент-Клэр Девилля, который впервые ввел понятие об обратимости химических реакций. Если S-молекула растворителя, а R-молекула растворяемого вещества, то в простейшем случае можно записать уравнение:
|
|
|
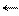 S + R→ SR
S + R→ SR
Так записывается равновесие, которое характеризует раствор в представлении Д.И. Менделеева. Точнее это равновесие записывается следующим образом:
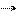 mS + пR.← SxRа + SyRβ + SzRУ+...
mS + пR.← SxRа + SyRβ + SzRУ+...
Таким образом, раствор - это сложная, термодинамически устойчивая химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Основываясь на приведенных уравнениях, Д. И. Менделеев объединил две теории на природу растворов, так как левая часть уравнений может символизировать физическую теорию, а правая - химическую. Он написал (1887 г.): "Растворы представляют жидкие ассоциированные системы, образованные частицами растворителя, растворенного вещества и тех определенных нестойких, но экзотермических соединений, которые между ними происходят, одного или нескольких, смотря по природе составляющих начал". В настоящее время обратимость реакций в растворах доказана экспериментально.
Основными компонентами раствора являются растворитель (дисперсионная среда) и растворенное вещество (дисперсная фаза). Это деление чисто условно. Если раствор образуется при смешивании компонентов одинакового агрегатного состояния, то растворителем считается компонент, которого в растворе больше. В остальных случаях растворителем обычно является жидкость или компонент агрегатное состояние которого не меняется при образовании раствора.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 864; Нарушение авторских прав?; Мы поможем в написании вашей работы!