
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакция диазотирования - -получение солей диазония
|
|
|
|
Способы получения
Ароматические диазосоединения
Более устойчивы, чем алифатические, т.к. имеются сопряжения.
Производные первичных ароматических аминов и азотистой кислоты.
Взаимодействие первичных ароматических аминов с солью азотистой кислоты в кислой среде.
C6H5NH2 + NaNO2 + 2 HCl 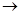 2H2O + NaCl + C6H5N2Cl
2H2O + NaCl + C6H5N2Cl
Эта реакция открыта в 1858 году студентом Гриссом в лаборатории Кольбе. Реакция вскоре после ее открытия приобрела большое прикладное значение и вошла в историю химии как реакция Грисса. Наряду с реакцией Зинина она является звеном в цепи открытий, которые привели к созданию химии азокрасителей. Химизм реакции сложен и включает в себя следующие стадии:
1. Образование и гидролиз соли амина.
+H2O
C6H5NH2 + HCl 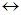 [C6H5N+H3]Cl
[C6H5N+H3]Cl
Но, так как ариламины слабее, образующаяся соль амина под действием воды частично гидролизуется, и в дальнейшую реакцию вступает свободный ароматический амин.
2. Образование диазотирующих агентов.
При действии сильной минеральной кислоты на нитрит натрия образуется свободная азотистая кислота.
NaNO2 + HCl 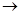 NaCl + HNO2
NaCl + HNO2
Однако, сама азотистая кислота является слабым диазотирующим агентом и превращается вначале в одну из активных форм.
а) при использовании концентрированных кислот в неводных растворах образуется нитрозоний-катион.
H+ + HONO 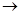 H2O + N+O
H2O + N+O
нитрозоний-катион
б) в присутствии соляной кислоты образуется хлористый нитрозил.
O=N-OH + HCl 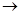 H2O + O=N-Cl
H2O + O=N-Cl
в) в кислой водной среде образуется нитрозацидий-ион
..
H+ + H-O-N=O 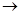
| 
|
г) в слабокислой среде, близкой к нейтральной, образуется азотистый ангидрид N2O3.
| HO-N=O | 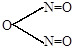
| |
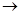 H2O + H2O +
| ||
| HO-N=O |
3 стадия - действие диазотирующих агентов на первичный амин с образованием нитрозамина.
|
|
|
а) C6H5-NH2 + N+O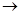 ..
..
| 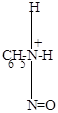
|
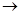 H+ + C6H5NH-N=O H+ + C6H5NH-N=O
|
| анилин нитрозоний- катион | ПП | N-нитрозоанилин |
б) С6H5-NH2 + Cl-N=O 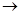 HCl + C6H5-NH-N=O
HCl + C6H5-NH-N=O
хлористый нитрозил
| в) | 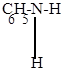
| + | 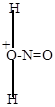
|
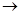 H3O+ + C6H5-NH-N=O H3O+ + C6H5-NH-N=O
|
| нитрозацидий-ион |
| г) | 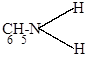
| + | 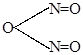
|
 HNO2 + C6H5-NH-N=O HNO2 + C6H5-NH-N=O
|
| азотистый ангидрид | N-нитрозанилин |
4 стадия – образование соли диазония.
Полученный нитрозанилин может существовать лишь в среде, близкой к нейтральной. В кислой среде его таутомерная форма – диазогидрат реагирует с избытком кислоты с образованием соли.
.. H+Cl-
С6H5-NH-N=O  C6H5-N=N-O-H
C6H5-N=N-O-H 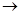 H2O + [C6H-N
H2O + [C6H-N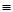 N]+Cl-
N]+Cl-
нитрозамин диазогидрат хлористый фенилдиазоний
Реакция диазотирования протекает быстро, но требует строгого соблюдения условий:
1. Избыток минеральной кислоты (2,5-3М на 1М амина), который необходим по следующим причинам:
а) для образования растворимой соли амина;
б) для образования активных диазотирующих агентов;
в) для образования соли диазония из нитрозамина, т.к. в недостаточно кислой среде соль диазония превращается в диазоаминосоединение.
С6H5N2Cl + H2NC6H5 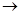 C6H5N=N-NH-C6H5
C6H5N=N-NH-C6H5
-HCl
диазоаминобензол (триазен)
2. Температура реакции должна быть не выше 50С, т.к.
а) при низкой температуре увеличивается растворимость (а, следовательно, и концентрация) диазотирующих газообразных агентов, и уменьшается выделение нитрозных газов вследствие разложения HNO2.
б) предотвращается разложение диазосоединений, которое может идти уже при комнатной температуре под действием воды, имеющейся в реакционной смеси, по уравнению:
С6H5N2Cl + HOH 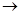 HCl + N2 + C6H5OH
HCl + N2 + C6H5OH
хлористый фенилдиазоний
II способ получения диазосоединений – получение гидратов окиси диазония действием гидроокиси серебра на раствор соли диазония.
C6H5N2Cl + AgOH 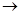 [C6H5N+
[C6H5N+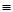 N]O-H + AgCl
N]O-H + AgCl 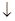
хлористый фенилдиазоний гидрат окиси фенилдиазония
Гидрат окиси фенилдиазония – неустойчивое взрывоопасное соединение, в воде нацело диссоциирует на ионы, является сильным основанием.
|
|
|
III способ получения диазосоединений – получение диазотатов.
Диазотаты образуются при действии на соли диазония избытком раствора щелочи.
избыток
NaOH
[C6H5-N+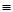 N]Cl + NaOH
N]Cl + NaOH 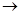 NaCl + C6H5-N=N-OH
NaCl + C6H5-N=N-OH 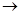 H2O + C6H5-N=N-ONa
H2O + C6H5-N=N-ONa
хлористый фенилдиазоний фенилдиазогидрат
Фенилдиазотат натрия, который существует в виде двух геометрических изомеров (син- и анти-изомерия).
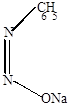
| 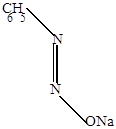
|
| cин-диазотат | антидиазотат (изодиазотат) |
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 3507; Нарушение авторских прав?; Мы поможем в написании вашей работы!