
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Стилистические проблемы перевода
|
|
|
|
0 +5 +5 +2
0 +5 + +2
3Ag + HNO3(P) + 3HNO3 = 3AgNO3 + NO + 2H2O
электронный баланс
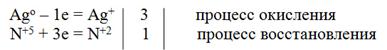
При действии концентрированной азотной кислоты на активные металлы образуется оксид азота(I)
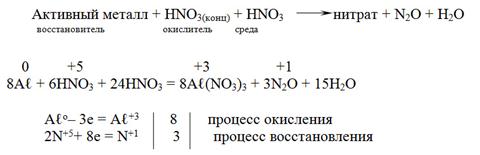
а в случае малоактивных металлов образуется оксид азота(IV)

Cu0 + 4HN+5O3(конц.) = Cu+2(NO3)2 + 2N+4O2 + 2H2O
электронный баланс
| Cu0 – 2ē = Cu2+ | |
| N5+ + ē = N4+ |
метод полуреакций
| Cu0 – 2ē = Cu2+ | |
| NO3- + 2H+ + ē = NO2 + H2O |
––––––––––––––––––––––––––––––––
Cu0 + 2NO3- + 4H+ = Cu2+ + 2NO2 + 2H2O
3Ag0 + 4HN+5O3(конц.) = 3Ag+1NO3 + N+2O + 2H2O
электронный баланс
| Ag0 - ē = Ag+ | |
| N5+ + 3ē = N2+ |
метод полуреакций
| Ag0 - ē = Ag+ | |
| NO3- + 4H+ + 3ē = NO + 2H2O |
––––––––––––––––––––––––––––––
3Ag0 + NO3- + 4H+ = 3Ag+ + NO + 2H2O
Чем активнее металл, реагирующий с кислотой, и чем более разбавлен ее раствор, тем полнее протекает восстановление. Например, реакции азотной кислоты разной концентрации с цинком
· Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2 + 2H2O
· 3Zn + 8HNO3(40 %) = 3Zn(NO3)2 + 2NO + 4H2O
· 4Zn + 10HNO3(20 %) = 4Zn(NO3)2 + N2O + 5H2O
· 5Zn + 12HNO3(6 %) = 5Zn(NO3)2 + N2 + 6H2O
· 4Zn + 10HNO3(0.5 %) = 4Zn(NO3)2 + NH4NO3 + 3H2O
С неметаллами HNO3 восстанавливается чаще до NO или NO2(реже). При этом неметалл полностью окисляется и превращается в высшую кислоту или в ангидрид, если кислота неустойчива
3P + 5HNO3(P) + 2H2O = 3H3PO4 + 5NO
электронный баланс
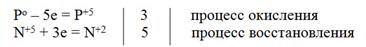
3C0 + 4HN+5O3 = 3C+4O2 + 4N+2O + 2H2O
электронный баланс
| C0 - 4ē = C4+ | |
| N5+ + 3ē = N2+ |
метод полуреакций
| C0 + 2H2O - 4ē = CO2 + 4H+ | |
| NO3- + 4H+ + 3ē = NO + 2H2O |
–––––––––––––––––––––––––––––––––––––––––––––
3C0 + 6H2O + 4NO3- + 16H+ = 3CO2 + 12H+ + 4NO + 8H2O
или 3C0 + 4NO3- + 4H+ = 3CO2 + 4NO + 2H2O
б) реакции с серной кислотой
В разбавленной серной кислоте окислителем является ион водорода (H+) и поэтому разбавленная H2SO4 взаимодействует только с активными металлами и при этом выделяется молекулярный водород
|
|
|
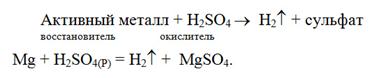
В концентрированной серной кислоте окислителем является S+6–ионы. Поэтому концентрированная серная кислота реагирует с активными и неактивными металлами, неметаллами и сложными веществами, восстанавливаясь при этом до Н2S, S и SO2, соответственно. Состав продуктов восстановления определяется главным образом активностью восстановителя, а также соотношением количеств восстановителя и серной кислоты, концентрацией кислоты и температурой системы. Чем активнее восстановитель и выше концентрация кислоты, тем более глубоко протекает восстановление.

Малоактивные металлы, а также бромоводород и некоторые неметаллы восстанавливают концентрированную серную кислоту до SO2

- компропорционированния (репропорционирование, конмутации, контрдиспропорционирования) – реакции, в которых участвуют два вещества, cодержащие атомы одного и того же элемента в разных степенях окисления, то есть окислитель и восстановитель один и тот же элемент, входящий в состав различных молекул в разных степенях окисления или реакции внутримолекулярного окисления- восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента
Cu0 + Cu+2Cl2 = 2Cu+1Cl
электронный баланс
 Cu+2 + е = Cu+1 1
Cu+2 + е = Cu+1 1
Cu0 - е = Cu+1 1
- реакции с участием озона. Озон является окислителем. В окислительно-восстанови-тельных реакциях с участием озона всегда выделяется кислород
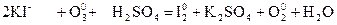
восстановитель окислитель среда
электронный баланс

- реакции с участием пероксида водорода. Пероксид водорода содержит кислород в промежуточной степени окисления, поэтому в реакциях может выступать в роли окислителя, и в роли восстановителя, а так же участвовать в реакции диспропорционирования. Пероксид водорода восстанавливается в зависимости от среды
|
|
|
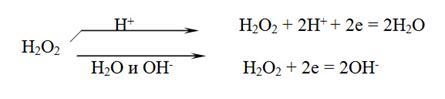
Обычно пероксид водорода используют как окислитель
H2O2 + 2HI- = I20 + 2H2O
электронный баланс
| 2I- - 2ē = I20 | |
| [O2]2- + 2ē = 2O2- |
метод полуреакций
| 2I- - 2ē = I20 | |
| H2O2 + 2H+ + 2ē = 2H2O |
––––––––––––––––––––––
2I- + H2O2 + 2H+ = I2 + 2H2O
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
восстановитель окислитель среда


2Fe2+ +H2O2 + 2H+ = 2Fe3+ + 2H2O.
В реакциях с сильным окислителем, таким, как перманганат калия KMnO4, персульфат аммония (NH4)2S2O8, пероксид водорода выступает как восстановитель, образуя кислород и воду
H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 + H2O
восстановитель окислитель среда
электронный баланс
| [O2]2- - 2ē = O20 | |
| Mn7+ + 5ē = Mn2+ |
метод полуреакций
| MnO4- + 8H+ + 5ē = Mn2+ + 4H2O | |
| H2O2 - 2ē = O2 + 2H+ |
––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 5H2O2 + 16H+ = 2Mn2+ + 8H2O + 5O2 + 10H+
или 2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 8H2O + 5O2
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 596; Нарушение авторских прав?; Мы поможем в написании вашей работы!