
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение. 1 Оксиды Na2O, K2O, Rb2O, Cs2O могут быть получены при недостатке кислорода или спекании в стехиометрическом количестве металла и пероксида:
|
|
|
|
1 Оксиды Na2O, K2O, Rb2O, Cs2O могут быть получены при недостатке кислорода или спекании в стехиометрическом количестве металла и пероксида:
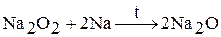
2. Оксиды Na2O, K2O, Rb2O, Cs2O образуются при термическом разложении пероксидов или надпероксидов в вакууме или инертной атмосфере.
3. Оксиды Na2O, K2O, Rb2O, Cs2O образуются при взаимодействии щелочного металла или его азида с нитратом или нитритом:
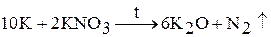
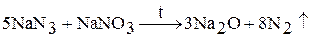
4. Удобным способом получении оксида натрия является взаимодействие натрия с расплавленным гидроксидом натрия:
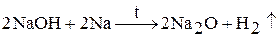
Оксиды лития и натрия – бесцветные, калия и рубидия – желтые, цезия – оранжевый.
Пероксиды содержат диамагнитный ион О22–.
Пероксиды щелочных металлов – сильные окислители. Например:
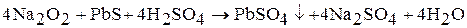
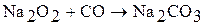
Пероксиды являются солями пероксида водорода, кислотные свойства выражены слабо, при растворении в воде подвергаются гидролизу:
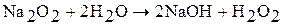
Прим. Образующийся пероксид водорода в щелочном растворе быстро разлагается на водород и кислород.
Пероксиды щелочных металлов при нагревании разлагаются:
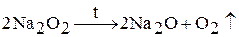
Надпероксиды содержат парамагнитный ион О2–.
Надпероксиды щелочных металлов являются сильными окислителями.
При взаимодействии надпероксидов с водой образуется пероксид водорода и кислород:
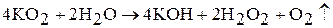
Надпероксиды щелочных металлов при нагревании разлагаются:
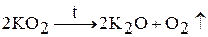
При взаимодействии пероксидов и надпероксидов с оксидом углерода (IV) происходит выделение кислорода. Например:
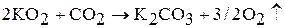
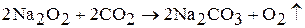
Данную реакцию используют для регенерации воздуха в замкнутых помещениях.
Для всех щелочных металлов были получены озониды MeO3, в состав которых входит парамагнитный ион О3–. Все озониды представляют собой кристаллические вещества оранжево-красного цвета. Взрывоопасны и неустойчивы (озонид калия разлагается при температуре 20 ºС за 11 дней).
|
|
|
Озониды щелочных металлов получают действием озона на пероксиды, надпероксиды или гидроксиды:
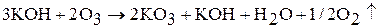
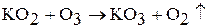
Озониды щелочных металлов при нагревании разлагаются:
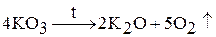
При взаимодействии озонидов с водой образуется кислород:
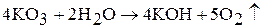
Гидроксиды щелочных металлов – бесцветные кристаллические вещества. Хорошо растворимы в воде. Это щелочи – растворимые в воде основания. В лаборатории чаще всего используем гидроксид натрия и гидроксид калия (технические названия – едкий натр и едкий кали).
Прим. щелочи при хранении поглощают из воздуха влагу и оксид углерода (IV). Если не принимать меры, то щелочи всегда будут содержать примесь воды и карбонатов. Для обезвоживания щелочи нагревают в атмосфере, не содержащей оксид углерода (IV). От примеси карбонатов освобождаются перекристаллизацией из этанола, в котором карбонаты не растворимы. Однако в большинстве случает небольшая примесь воды и карбонатов не мешает использованию щелочей и указанную очистку не проводят.
Гидроксиды натрия, калия, рубидия и цезия плавятся без разложения (т.е. они термически устойчивы до температуры более 1000 ºС). Гидроксид лития при прокаливании разлагается:
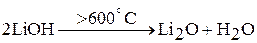
Данная реакция начинает протекать при температуре 600 ºС.
Прим. твердые щелочи и их концентрированные растворы разрушают живые ткани. Поэтому работать с щелочами необходимо соблюдая меры осторожности (резиновые перчатки, защитные очки). Особенно опасно попадание щелочи в глаза (ведет к слепоте).
Щелочи при плавлении разрушают стекло и фарфор:
2NaOH + SiO2 ® Na2SiO3 + H2O
Плавят щелочи в сосудах изз серебра, никеля или железа, хранят в полиэтиленовых сосудах.
Наиболее практическое значение имеет гидроксид натрия.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1496; Нарушение авторских прав?; Мы поможем в написании вашей работы!