
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подвижность ионов, закон Кольрауша
|
|
|
|
В бесконечно разбавленных растворах эквивалентная электропроводность достигает предела и от концентрации больше не зависит, так как в растворах слабых электролитов наступает полная диссоциация (α = 1), а в растворах сильных электролитов межионное взаимодействие исчезает.
Эквивалентная электропроводность бесконечно разбавленных растворов называется электропроводностью при бесконечном разведении и обозначается l∞ (или l0).
Эквивалентная электропроводность при бесконечном разведении, согласно закону независимого движения ионов Кольрауша, равна сумме предельных подвижностей ионов
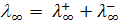 (10.5)
(10.5)
Подвижность связана с абсолютной скоростью движения ионов n:
l+=n+ F, l-=n- F, 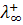 =
=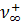 F,
F, 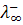 =
=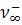 F
F
где F – число Фарадея, 96487 к. ≈ 96500к.
Под абсолютной скоростью движения иона v, понимают скорость перемещения его в электрическом поле с градиентом потенциала 1 в/см. Размерность n см2 сек-1 – в-1. Величина абсолютной скорости движения иона при прочих равных условиях (температура, вязкость среды, градиент поля) зависит от концентрации раствора и достигает предельного значения в бесконечно разбавленных растворах, т. е. при φ→∞, n +→ 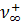 , n-→
, n-→ 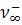 .Taк как скорость движения ионов очень мала, то используют величины в F раз большие — подвижности l + и l -.
.Taк как скорость движения ионов очень мала, то используют величины в F раз большие — подвижности l + и l -.
Подвижность также называется эквивалентной электропроводностью ионов. Она измеряется в тех же единицах, что и эквивалентная электропроводность электролита (Ом-1см2-г-экв-1). Подвижности ионов зависят от концентрации, особенно в растворах сильных электролитов, в которых межионное взаимодействие велико (fl < 1). Предельные подвижности ионов 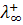 и
и 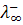 достигаются при бесконечном разведении (φ→∞,fl →1), их значения приводятся в справочной литературе.
достигаются при бесконечном разведении (φ→∞,fl →1), их значения приводятся в справочной литературе.
|
|
|
Зависимость эквивалентной электропроводности от степени диссоциации и межионного взаимодействия описывается уравнением:
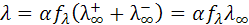 (10.6)
(10.6)
В растворах слабых электролитов число ионов, участвующих в переносе электричества, определяется степенью диссоциации a. В концентрированных растворах слабых электролитов α весьма мала, поэтому и число ионов в растворе также мало и практически отсутствует межионное взаимодействие. При сильном разбавлении растворов α возрастает и увеличивается число
ионов в растворе, однако межионные расстояния так велики, что взаимодействие ионов также отсутствует (fl = 1). Таким образом, в растворах слабых электролитов при любых разведениях ионы обладают предельной подвижностью 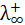 и
и 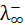 и эквивалентная электропроводность зависит только от степени диссоциации
и эквивалентная электропроводность зависит только от степени диссоциации
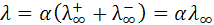
Следовательно, отношение электропроводностей будет отвечать степени диссоциации слабых электролитов
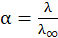 (10.7)
(10.7)
Это уравнение называют формулой Аррениуса, на практике его используют для определения степени диссоциации растворов электролитов.
Для 1–1–валентного слабого электролита, диссоциирующего по схеме АВ↔А+ В–, используя закон разведения Оствальда и учитывая, что 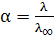 можно определить константу диссоциации через эквивалентную электропроводность по формуле:
можно определить константу диссоциации через эквивалентную электропроводность по формуле:
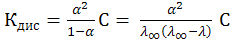 (10.8)
(10.8)
где С – концентрация электролита, моль/л.
Согласно теории Дебая-Хюккеля, сильные электролиты в растворах полностью диссоциированы на ионы (α =1) и межионные взаимодействия велики (fl < 1), значит уравнение (10.6) должно быть записано в виде
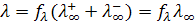 (10.9)
(10.9)
откуда коэффициент электропроводности равен
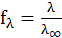 ;
;
Коэффициент электропроводности является функцией концентрации, экспериментально его определяют исходя из эквивалентной электропроводности раствора. Величина 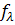 зависит от валентности ионов: 1–1–валентного электролита (типа NaCI, HCI) в 0,1 н. растворе
зависит от валентности ионов: 1–1–валентного электролита (типа NaCI, HCI) в 0,1 н. растворе 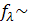 0,8; для 1–2–валентных (Na2SО4, СаСI2) fx ~ 0,75; 2–2–валентных (CuSО4)
0,8; для 1–2–валентных (Na2SО4, СаСI2) fx ~ 0,75; 2–2–валентных (CuSО4) 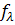 ~ 0,4. При разбавлении растворов уменьшается межионное взаимодействие, и эти различия сглаживаются: эквивалентная электропроводность достигает предела
~ 0,4. При разбавлении растворов уменьшается межионное взаимодействие, и эти различия сглаживаются: эквивалентная электропроводность достигает предела 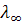 и
и 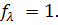
|
|
|
10.4 Механизм влияния ионов атмосферы на электропроводность
растворов, закон квадратного корня Кольрауша.
Качественно механизм влияния ионной атмосферы на электропроводность состоит в следующем: центральный ион, например катион, при наложении постоянного электрического поля движется к катоду, противоположно заряженная ионная атмосфера перемещается к аноду. Это вызывает так называемое электрофоретическое торможение.
Окружающая центральный ион атмосфера должна исчезать позади иона, движущегося в электрическом поле, и вновь образовываться впереди него. Оба процесса разрушения и образования ионной атмосферы происходят не мгновенно, например в 0,1 н растворе хлористого калия за 0,6·10-9 сек, а в 0,001 н растворе – за 0,6·10-7сек. Это вызывает релаксационное торможение. Поэтому коэффициент электропроводности принимает значения меньше единицы не в результате неполной диссоциации, а за счет проявления этих торможений.
Кроме электрофоретического и релаксационного торможения, существует третья сила, тормозящая движение ионов в растворе. Это сила трения, зависящая от вязкости растворителя, в котором движется ион. Поэтому повышение температуры вызывает увеличение скорости движения ионов, и как следствие возрастание электропроводности.
Для разбавленных растворов сильных электролитов теория дает линейную зависимость эквивалентной электропроводности от корня квадратного из концентрации (закон квадратного корня Кольрауша)
 (10.9)
(10.9)
Постоянная А, зависящая от природы растворителя, температуры и валентного типа электролита, экспериментально определяется тангенсом угла наклона прямой 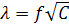 к оси абсцисс (рис. 10.2).
к оси абсцисс (рис. 10.2).
Предельную эквивалентную электропроводность 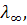 сильных электролитов можно найти экстраполяцией опытных данных
сильных электролитов можно найти экстраполяцией опытных данных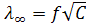 до значения С = 0. Необходимо подчеркнуть, что, хотя предельную электропроводность понимают как проводимость при концентрации электролита, близкой к нулю, она никоим образом не идентична эквивалентной электропроводности растворителя.
до значения С = 0. Необходимо подчеркнуть, что, хотя предельную электропроводность понимают как проводимость при концентрации электролита, близкой к нулю, она никоим образом не идентична эквивалентной электропроводности растворителя.
|
|
|

Рис. 10.2 Зависимость эквивалентной электропроводности от корня квадратного из концентрации для сильных электролитов (НСI, КОН, LiCI)  , и слабого электролита (СН3СООН) в водных растворах.
, и слабого электролита (СН3СООН) в водных растворах.
Для растворов слабых электролитов зависимость эквивалентной
электропроводности от концентрации вытекает из закона разбавления Оствальда. При α 1 получаем
1 получаем
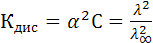 (10.10)
(10.10)
откуда 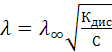
или в логарифмическом виде
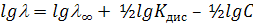
Эта зависимость не является линейной, поэтому значение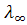 , невозможно определить экстраполяцией, его определяют только косвенным путем исходя из закона независимого движения ионов Кольрауша.
, невозможно определить экстраполяцией, его определяют только косвенным путем исходя из закона независимого движения ионов Кольрауша.
Данные о подвижности ионов показывают, что радиусы ионов в кристаллической решетке не сохраняются в растворах. Например, радиусы
ионов щелочных металлов по ряду Li+<Na+<K+<Rb+<Cs+ возрастают, однако в растворе наблюдается обратный порядок. Ион Li + имеет более сильное электрическое поле, так как его удельный заряд (отношение величины заряда частицы к ее массе) больше, чем других щелочных ионов, поэтому в растворе он гидратируется сильнее. Сильно гидратированный ион Li+ движется между молекулами воды в электрическом поле гораздо медленнее, чем менее гидратированпый ион Cs+ (например,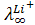 = 38,6;
= 38,6; 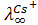 = 77,2 ом-1 см 2 г-экв-1).
= 77,2 ом-1 см 2 г-экв-1).
С увеличением заряда ионов скорость перемещения его в электрическом поле, а, следовательно, и электропроводность раствора возрастают. Однако самыми большими скоростями обладают ионы Н+ (точнее ионы гидроксония) и ОН-. Только их подвижности выражаются трехзначными числами (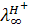 = 349,8;
= 349,8;  =198,3 ом-1-см2-экв-1). Это, по-видимому, объясняется тем, что протон может переносится от молекулы к молекуле воды по так называемому «эстафетному» механизму
=198,3 ом-1-см2-экв-1). Это, по-видимому, объясняется тем, что протон может переносится от молекулы к молекуле воды по так называемому «эстафетному» механизму
анод (+) | Н3O+ 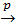 Н2O| катод (–).
Н2O| катод (–).
В результате такого перескока протон проходит 0,86 А, что отвечает перемещению катиона гидроксония на 3,1 Ǻ, или перенос гидроксила в электрическом поле к аноду
анод (+) | Н2O 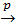 ОН– | катод (–),
ОН– | катод (–),
|
|
|
при котором перескок протона вправо имеет следствием перемещение гидроксила влево. При этом гидроксил, принимающий протон, превращается в молекулу воды, а вместо него возникает новый анион, находящийся к аноду ближе, чем тот, который исчезает вследствие присоединения протона. Естественно, что при таком механизме проводимости подвижность ионов водорода и гидроксила значительно больше, чем ионов, которые просто двигаются в электрическом поле.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 22824; Нарушение авторских прав?; Мы поможем в написании вашей работы!