
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Курс лекций по биохимии
Пособие для студентов лечебного и педиатрического факультетов
Гродно
УДК
ББК
К93
Рекомендовано Центральным научно-методическим советом УО «ГрГМУ» (протокол № ___ от ___________).
Авторы: зав. каф. биологической химии, проф. В.В. Лелевич;
доц. И.О. Леднева;
канд. мед. наук, ассист. М.Н. Курбат;
доц. Н.Э. Петушок;
доц. В.В. Воробьев.
Рецензент: зав. каф. биохимии Гродненского государственного университета
им. Я. Купалы д-р биол. наук И. Б. Заводник.
| К93 | Курс лекций по биохимии: пособие для студентов лечебного и педиатрического факультетов / В.В. Лелевич [и др.]. – Гродно: ГрГМУ, 2009. – 316 с. |
ISBN
В пособии представлены и систематизированы современные сведения по всем разделам биохимии. Рассматриваются основные положения статической, динамической и фундаментальной биохимии. Приведена характеристика метаболизма белков, углеводов, липидов, нуклеиновых кислот внорме и при некоторых патологических состояниях. Охарактеризованы особенности метаболизма в различных органах и тканях. Изложены современные представления о молекулярных основах наругшений при ряде патологических состояний и болезней.
Предназначено для студентов медицинских вузов, биологов, врачей.
УДК
ББК
ISBN
© УО «ГрГМУ», 2009

СПИСОК СОКРАЩЕНИЙ
АДГ – антидиуретический гормон (вазопрессин)
АДФ – аденозиндифосфорная кислота, аденозиндифосфаты
АКТГ – адренокортикотропный гормон
АлАТ – аланинаминотрансфераза
АМФ – аденозинмонофосфат
цАМФ – циклический аденозин-3',5'-монофосфат
АсАТ – аспартатаминотрансфераза
АТФ – аденозинтрифосфорная кислота
АТФ-аза – аденозинтрифосфатаза
АХАТ – КоА-холестеролацилтрансфераза
ГАМК – γ-аминомасляная кислота
ГДФ – гуанозиндифосфат
ГТФ – гуанозинтрифосфат
ДНК – дезоксирибонуклеиновая кислота
ДОФА – диоксифенилаланин
ДФФ – диизопропилфторфосфат
ИМФ – инозинмонофосфат
КоА – кофермент (коэнзим) А
КоQ – кофермент (коэнзим) Q
ЛДГ – лактатдегидрогеназа
ЛП – липопротеины
ЛПВП – липопротеины высокой плотности
ЛПЛ – липопротеинлипаза
ЛПНП – липопротеины низкой плотности
ЛПОНП – липопротеины очень низкой плотности
ЛППП – липопротеины промежуточной плотности
ЛХАТ – лецитинхолестеролацилтрансфераза
МАО – моноаминооксидаза
ПОЛ – перекисное окисление липидов
ПЦР – полимеразная цепная реакция
РНК – рибонуклеиновая кислота
мРНК – матричная РНК
рРНК – рибосомальная РНК
тРНК – транспортная РНК
СТГ – соматотропный гормон
ТАГ – триацилглицеролы
ТДФ – тиаминдифосфат
ТТГ – тиреотропный гормон
УДФ – уридиндифосфат
УТФ – уридинтрифосфат
ФАФС – 3-фосфоаденозин-5-фосфосульфат
ХМ – хиломикроны
ЦНС – центральная нервная система
ЦТД – цепь тканевого дыхания
ЦТК – цикл трикарбоновых кислот, цикл Кребса
глава 1
ВВЕДЕНИЕ В БИОХИМИЮ
Биологическая химия – наука, изучающая химическую природу веществ, входящих в состав живых организмов, превращения этих веществ (метаболизм), а также связь этих превращений с деятельностью отдельных тканей и всего организма в целом.
Биохимия – это наука о молекулярных основах жизни. Существует несколько причин тому, что в наши дни биохимия привлекает большое внимание и быстро развивается.
Во-первых, биохимикам удалось выяснить химические основы ряда важнейших биохимических процессов.
Во-вторых, обнаружены общие пути превращения молекул и общие принципы, лежащие в основе разнообразных проявлений жизни.
В-третьих, биохимия оказывает все более глубокое воздействие на медицину.
В-четвертых, быстрое развитие биохимии в последние годы позволило исследователям приступить к изучению самых острых, коренных проблем биологии и медицины.
История развития биохимии
В истории развития биохимических знаний и биохимии как науки можно выделить 4 периода.
I период – с древних времен до эпохи Возрождения (XV век). Это период практического использования биохимических процессов без знаний их теоретических основ и первых, порой очень примитивных, биохимических исследований. В самые отдаленные времена люди уже знали технологию таких производств, основанных на биохимических процессах, как хлебопечение, сыроварение, виноделие, дубление кож. Использование растений в пищевых целях, для приготовления красок, тканей наталкивало на попытки понять свойства отдельных веществ растительного происхождения.
II период – от начала эпохи Возрождения до второй половины 19 века, когда биохимия становится самостоятельной наукой. Великий исследователь того времени, автор многих шедевров искусства, архитектор, инженер, анатом Леонардо да Винчи провел опыты и на основании их результатов сделал важный для тех лет вывод, что живой организм способен существовать только в такой атмосфере, в которой может гореть пламя.
В этот период следует выделить работы таких ученых, как Парацельс, М. В. Ломоносов, Ю. Либих, А. М. Бутлеров, Лавуазье.
III период – со второй половины 19 века до 50-х годов 20 века. Ознаменован резким увеличением интенсивности и глубины биохимических исследований, объема получаемой информации, возросшим прикладным значением – использованием достижений биохимии в промышленности, медицине, сельском хозяйстве. К этому времени относятся работы одного из основоположников отечественной биохимии А. Я. Данилевского (1838-1923), М. В. Ненцкого (1847-1901). На рубеже 19 и 20 веков работал крупнейший немецкий химик-органик и биохимик Э. Фишер (1862-1919). Им были сформулированы основные положения полипептидной теории белков, начало которой дали исследования А. Я. Данилевского. К этому времени относятся работы великого русского ученого К. А. Тимирязева (1843-1920), основателя советской биохимической школы А. Н. Баха, немецкого биохимика О. Варбурга. В 1933 г. Г. Кребс подробно изучил орнитиновый цикл образования мочевины, а 1937 г. датируется открытие им же цикла трикарбоновых кислот. В 1933 г. Д. Кейлин (Англия) выделил цитохром С и воспроизвел процесс переноса электронов по дыхательной цепи в препаратах из сердечной мышцы. В 1938 г. А. Е. Браунштейн и М. Г. Крицман впервые описали реакции трансаминирования, являющиеся ключевыми в азотистом обмене.
IV период – с начала 50-х годов 20 века по настоящее время. Характеризуется широким использованием в биохимических исследованиях физических, физико-химических, математических методов, активным и успешным изучением основных биологических процессов (биосинтез белков и нуклеиновых кислот) на молекулярном и надмолекулярном уровнях.
Вот краткая хронология основных открытий в биохимии этого периода:
1953 г. – Дж. Уотсон и Ф. Крик предложили модель двойной спирали строения ДНК.
1953 г. – Ф. Сенгер впервые расшифровал аминокислотную последовательность белка инсулина.
1961 г. – М. Ниренберг расшифровал первую «букву» кода белкового синтеза – триплет ДНК, соответствующий фенилаланину.
1966 г. – П. Митчелл сформулировал хемиосмотическую теорию сопряжения дыхания и окислительного-фосфорилирования.
1969 г. – Р. Мерифильд химическим путем синтезировал фермент рибонуклеазу.
1971 г. – в совместной работе двух лабораторий, руководимых Ю. А. Овчинниковым и А. Е. Браунштейном, установлена первичная структура аспартатаминотрансферазы – белка из 412 аминокислот.
1977 г. – Ф. Сенгер впервые полностью расшифровал первичную структуру молекулы ДНК (фаг φ Х 174).
Развитие медицинской биохимии в Беларуси
С момента создания в 1923 г. в Белорусском государственном университете кафедры биохимии началась профессиональная подготовка национальных биохимических кадров. В 1934 г. организована кафедра биохимии в Витебском медицинском институте, в 1959 г. – в Гродненском медицинском институте, в 1992 г. – в Гомельском медицинском институте. На заведование кафедрами приглашались и избирались известные ученые, крупные специалисты в области биохимии: А. П. Бестужев, Г. В. Дервиз, Л. Е. Таранович, Н. Е. Глушакова, В. К. Кухта, В. С. Шапот, Л. Г. Орлова, А. А. Чиркин, Ю. М. Островский, Н. К. Лукашик. На формирование научных школ в области медицинской биохимии огромное влияние оказала деятельность таких выдающихся ученых, как М. Ф. Мережинский (1906-1970), В. А. Бондарин (1909-1985), Л. С. Черкасова (1909-1998), В. С. Шапот (1909-1989), Ю. М. Островский (1925-1991), А. Т. Пикулев (1931-1993).
В 1970 г. в г. Гродно создан Отдел регуляции обмена веществ АН БССР, преобразованный в 1985 г. в Институт биохимии Национальной академии наук Беларуси. Первым заведующим отделом и директором института был академик АН БССР Ю. М. Островский. Под его руководством было начато всестороннее изучение витаминов, в частности, тиамина. Работы
Ю. М. Островского дополнены и продолжены в исследованиях его учеников: Н. К. Лукашика, А. И. Балаклеевского, А. Н. Разумовича, Р. В. Требухиной, Ф. С. Ларина, А. Г. Мойсеенка.
Наиболее важными практическими результатами деятельности научных биохимических школ явилась организация государственной лабораторной службы республики (профессор
В.Г. Колб), открытие в Витебском медицинском институте Республиканского липидного лечебно-диагностического центра метаболической терапии (профессор А. А. Чиркин), создание в Гродненском медицинском институте лаборатории медико-биологических проблем наркологии (профессор В. В. Лелевич).
Содержание предмета биохимии
- Состав и строение химических веществ живого организма – статическая биохимия.
- Вся совокупность превращения веществ в организме (метаболизм) – динамическая биохимия.
- Биохимические процессы, лежащие в основе различных проявлений жизнедеятельности – функциональная биохимия.
- Структура и механизм действия ферментов – энзимология.
- Биоэнергетика.
- Молекулярные основы наследственности – передача генетической информации.
- Регуляторные механизмы метаболизма.
- Молекулярные механизмы специфических функциональных процессов.
- Особенности метаболизма в органах и тканях.
Разделы и направления биохимии
1. Биохимия человека и животных.
2. Биохимия растений.
3. Биохимия микроорганизмов.
4. Медицинская биохимия.
5. Техническая биохимия.
6. Эволюционная биохимия.
7. Квантовая биохимия.
Объекты биохимических исследований
1. Организмы.
2. Отдельные органы и ткани.
3. Срезы органов и тканей.
4. Гомогенаты органов и тканей.
5. Биологические жидкости.
6. Клетки.
7. Дрожжи, бактерии.
8. Субклеточные компоненты и органоиды.
9. Ферменты.
10.Химические вещества (метаболиты).
Методы биохимии
1. Гомогенизация тканей.
2. Центрифугирование:
а) простое
б) ультрацентрифугирование
в) центрифугирование в градиенте плотности.
3. Диализ.
4. Электрофорез.
5. Хроматография.
6. Изотопный метод.
7. Колориметрия.
8. Спектрофотометрия.
9. Определение ферментативной активности.
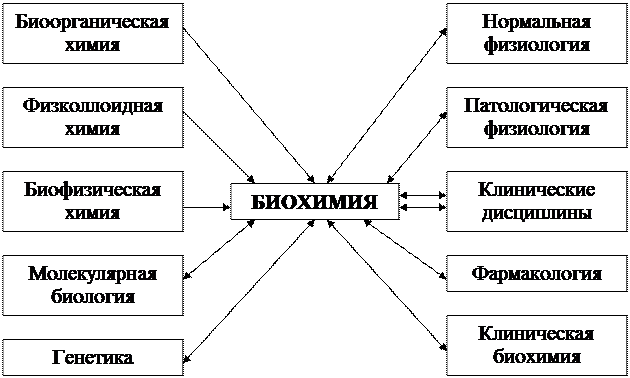
Рис. 1.1. Связь биохимии с другими дисциплинами
ГЛАВА 2
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных в полипептидные цепи с помощью пептидных связей, и имеющие сложную структурную организацию.
История изучения белков
В 1728 г. Беккари выделил первое вещество из пшеничной муки, названное «клейковиной». Он же показал его сходство с белком куриного яйца.
В 1820 г. Браконно открыл в продуктах гидролиза белков аминокислоту глицин.
В 1838 г. после систематического изучения элементного состава разных белков Мульдер предложил теорию протеина (универсальный принцип построения белковых веществ).
В 1888 г. А. Я. Данилевский выдвинул гипотезу строения белков, получившую название «теории элементарных рядов». Он первым предложил существование в белках связей (-NH-CO-), как в биурете.
В 1890 г. Гофмейстер впервые получил кристаллический белок – яичный альбумин.
В 1902 г. Фишер и Гофмейстер предложили пептидную теорию строения белка. В то же время Фишер с сотрудниками синтезировал в лаборатории первые пептиды.
В 1925-1930 гг. Сведберг сконструировал ультрацентрифугу и использовал ее для определения молекулярной массы белков.
В 1951 г. Полинг и Кори разработали модель вторичной структуры белка, названной α-спиралью.
В 1952 г. Линдерстрём-Ланг предположил существование трех уровней организации белковой молекулы: первичной, вторичной и третичной.
В 1953 г. Сенгер впервые расшифровал аминокислотную последовательность белка – инсулина.
В 1958 г. Кендрью и в 1959 г. Перутц расшифровали третичную структуру белков – миоглобина и гемоглобина.
Аминокислоты и их роль в организме
Аминокислоты – органические карбоновые кислоты, у которых как минимум один из атомов водорода углеводородной цепи замещен на аминогруппу.
В природе встречается примерно 300 аминокислот. Многие из них найдены только в определенных организмах, а некоторые – только в одном каком-либо организме. В организме человека содержится около 60 различных аминокислот и их производных.
Аминокислоты делятся на две группы: протеиногенные (входящие в состав белков – их 20) и непротеиногенные (не участвующие в образовании белков).
Приняты три классификации аминокислот:
1. Структурная – по строению бокового радикала;
2. Электрохимическая – по кислотно-основным свойствам;
3. Биологическая – по степени незаменимости аминокислот для организма.
Незаменимые аминокислоты не могут синтезироваться организмом из других соединений, поэтому они обязательно должны поступать с пищей. Абсолютно незаменимых аминокислот для человека восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.
Частично заменимыми аминокислотами являются – аргинин и гистидин.
|
Дата добавления: 2014-01-03; Просмотров: 2896; Нарушение авторских прав?; Мы поможем в написании вашей работы!