
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подход «снизу-вверх», т.е. получение нанометровых изделий или материалов методами сборки на атомарном уровне 5 страница
 |
Первичные элементы. Наибольшее распространение раньше имели элементы типа Даниеля – Якоби. В начале 20 века довольно широко использовались для бытовых целей (электрические звонки, телефон) марганцево-цинковые элементы типа Лекланше, известные всем под названием сухого элемента. Наряду с аккумуляторами основным видом химических источников энергии становятся «сухие» элементы Лекланше в разнообразном конструктивном оформлении.
Схематически элемент может быть изображен так:
Zn│NH4Cl│(MnO2)C
Угольный электрод является лишь токоподводом, необходимым потому, что MnO2 имеет высокое удельное сопротивление. По этой же причине при изготовлении элемента MnO2 для увеличения электропроводности смешивают с порошком графита.
Цинковый сосуд, в котором помещается этот элемент представляет собой анод; катодом служит угольный стержень. На катоде происходит довольно сложная реакция. Электролит содержит мелко размельченный MnO2, а так же хлорид аммония, оба вещества участвуют в восстановительной реакции. Анодную и катодную реакции, протекающие в элементе Лекланше, обычно описывают уравнениями
Zn → Zn2+ + 2е- (2)
2MnO2 + 4NH4 + + 2е- → Mn2О3+ 2NH3 + Н2О (3)
Выделяющийся на катоде аммиак образует с ионами цинка, возникающими на аноде, комплексный ион Zn(NH3)42+ и элемент может действовать до тех пор, пока не израсходуется один из реагентов.
Обычно цинковую оболочку элемента делают достаточно толстой, чтобы предотвратить вытекание из нее электролита. Казалось бы, при нагревании сухого элемента или выдерживании его некоторое время в разомкнутом состоянии произойдет его регенерация, однако таким путем достигается лишь диффузия продуктов реакции от электродов, где повышении их концентрации приводит к перенапряжению, или возникновению обратного потенциала, который препятствует протеканию прямой реакции.
|
|
|
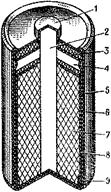
Рисунок 3 - Марганцево-цинковый элемент стаканчиковой конструкции: 1 - колпачок; 2 - угольный стержень; 3 - смолка; 4 - газовое пространство; 5 - цинковый стакан; 6 - картонная оболочка; 7 - положительный электрод из двуокиси марганца; 8 - прокладка между положительным и отрицательным электродами, пропитанная электролитом; 9 - картонная шайба на дне цинкового стакана
Вторичные источники тока или аккумуляторы.
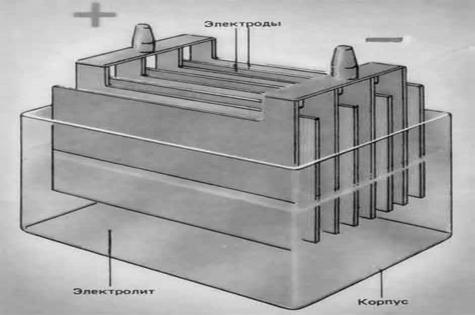
Свинцовые кислотные аккумуляторы состоят из следующих основных частей:
а) положительных пластин различной конструкции, в которых активным материалом является двуокись свинца;
б) отрицательных пластин с активным материалом – губчатым свинцом;
в) электролита – раствора серной кислоты;
г) токоведущих частей: бареток, состоящих из мостиков, связывающих в один полублок параллельно включенные пластины одного знака заряда, и выводных штырей-борнов. Для последовательного включения аккумуляторов в батареи служат межэлементные соединения;
д) изолирующих разделителей-сепараторов, предохраняющих от коротких замыканий между пластинами разного знака заряда;
е) аккумуляторных сосудов из кислотоупорных материалов.
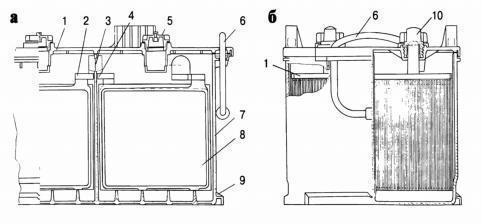
Рисунок 4 - Аккумуляторная батарея 6СЕ – 190А (стартерная свинцовая аккумуляторная батарея для грузовых автомобилей): а – продольный разрез; 6 – поперечный разрез; 1 – крышка; 2 – мостик; 3 – межэлементная перемычка; 4 – перегородка моноблока; 5 – пробка; 6 – ручка переносного устройства; 7 – моноблок; 8 – блок электродов; 9 – выступы моноблока; 10 – полюсный вывод.
Уравнение, выражающее основной процесс в свинцовом аккумуляторе:
Pb│H2SO4│PbO2
Pb + PbO2 + 2H2SO4 ↔ 2PbSO4 + 2H2O (4)
Процессы на электродах могут быть представлены следующим образом:
|
|
|
на отрицательном: Pb + H2SO4 ↔ PbSO4 + 2H+ +2e (5)
на положительном: PbO2 + 2H+ + H2SO4 ↔ PbSO4 + 2H2 – 2e (6)
Топливные элементы. В последнее время затрачиваются большие усилия на создание так называемых топливных элементов, т.е. электрохимических элементов, требующих в процессе своего действия постоянного расходования электродного вещества. В одном из простейших топливных элементов происходит поглощение водорода и кислорода в присутствии щелочного раствора. Газы поступают в элемент сквозь пористые угольные электроды. Электродные полуреакции описываются уравнениями
2H2 + 4OH-→ 4H2O + 4e- (7)
O2 + 2H2O + 4e-→ 4OH- (8)
2H2 + O2 → 2H2O (9)
Химические реакции в топливных элементах (рисунок 5) идут на специальных пористых электродах (аноде и катоде), активированных палладием или другими металлами платиновой группы, где химическая энергия, запасенная в водороде и кислороде эффективно преобразуется в электрическую энергию. Водород окисляется на аноде, а кислород восстанавливается на катоде.
Катализатор на аноде ускоряет окисление водородных молекул в водородные ионы и электроны. Водородные ионы (протоны) через мембрану мигрируют к катоду, где катализатор катода вызывает образование воды из комбинации протонов, электронов и кислорода. Поток электронов через внешний кругооборот производит электрический ток, который используется различными потребителями.
Напряжение, возникающее на отдельном топливном элементе не превышает 1,1 В. Для получения необходимой величины напряжения ТЭ соединяются непосредственно в батареи, а для получения необходимой мощности батареи ТЭ соединяются параллельно. Такие батареи ТЭ вместе с элементами газораспределения и терморегулирования монтируются в единый конструктивный блок, называемый электрохимическим генератором.
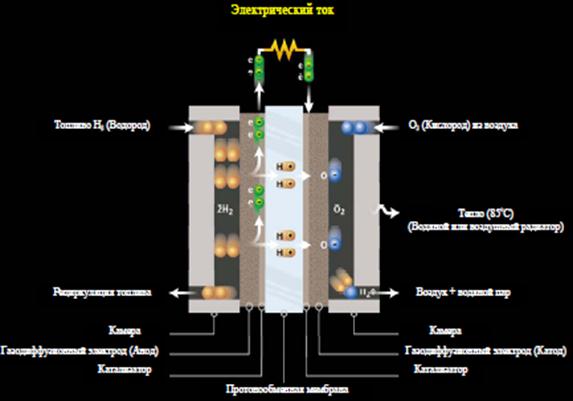
Рисунок 5 – схема протонно-обменного топливного элемента
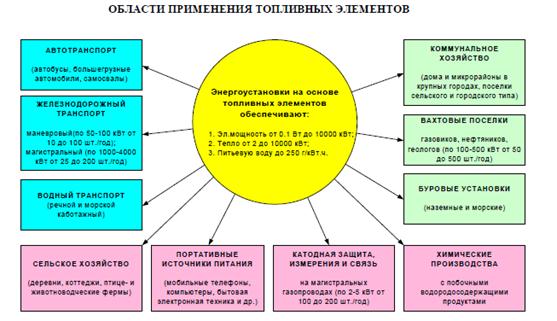
Элементы, в которых происходит окисление обычного топлива или продуктов его переработки (водорода, окиси углерода, водяного газа и др.) и за счет изменения изобарно-изотермического потенциала реакции образуется электрическая энергия, получили название топливных элементов. Позднее это понятие было расширено. Топливными элементами стали называться химические источники тока, в которых активные вещества, участвующие в токообразующей реакции, в процессе работы элемента непрерывно подаются извне к электродам. Комплекс батарей топливных элементов и обслуживающих систем, например установка для охлаждения, называется электрическим генератором.
|
|
|
Классификация топливных элементов. Они подразделяются на элементы прямого действия, в которых активными веществами служат поступающие к электродам топливо и окислитель (обычно кислород), и элементы с регенерацией активных веществ, участвующих в работе в ограниченном количестве. Топливо и окислитель в этом случае обычно расходуются в процессах, связанных с регенерацией.
Преимущества и применение топливных элементов. Наиболее простым топливным элементом является водородно-кислородный источник тока. Это объясняется способностью водорода к ионизации на аноде и возможностью работы такого элемента при относительно низкой температуре.
Первые опыты по созданию водородно-кислородного элемента были проведены Грове в 1839 г. Однако элемент долгое время не находил практического применения вследствие сильной поляризации, возникавшей в нем даже при разряде малым током. В работах Давтяна (1947 г.) была показана возможность увеличения скорости электродных процессов за счет применения катализатора, повышения температуры и давления внутри элемента. С этого времени фронт работы в области создания топливных элементов значительно расширился. В последние годы топливные элементы нашли практическое применение.
Создание топливных элементов с высокими показателями работы имеет важное народно-хозяйственное значение. Это объясняется тем, что в современных теплосиловых установках при получении электрической энергии теплота сгорания топлива используется лишь на 30—40%. В топливном элементе коэффициент использования теоретически может достигать 100%. Помимо высокого к. п. д. топливные элементы обладают большой удельной мощностью и значительной удельной энергией. Они надежны в работе и потребляют сравнительно доступные активные материалы. В них отсутствуют движущиеся части, они бесшумны и при работе не выделяют вредных веществ. Вода, образующаяся при реакции, может быть использована.
|
|
|
Представляет интерес возможное применение топливных элементов в электроавтомобилях. Однако для более широкого использования необходимо значительное снижение стоимости элементов и повышение их удельных характеристик.
Низкотемпературные топливные элементы
Устройство элемента, работающего на газообразном топливе, показано на рис. 6. Элемент может иметь плоские электроды, расположенные параллельно друг другу (а), или цилиндрические электроды, помещенные концентрически один в другом (б). Электроды могут быть металлическими и угольными. В обоих случаях источник тока имеет три зоны: газовую камеру, через которую циркулирует топливо; газовую камеру, в которую подается окислитель, и пространство, занимаемое электролитом. Последнее отделено от газовых камер диффузионными электродами, позволяющими газу соприкасаться с электролитом. Продукты реакции удаляются вместе с циркулирующими газами.
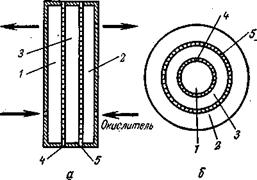
Рис. 6. Схема устройства топливного элемента:
а— элемент с плоскими электродами; б— элемент с трубчатыми электродами; 1 — газовая камера топлива; 2 — газовая камера окислителя; 3— электролит; 4— диффузионный анод; 5— диффузионный катод.
Реакции, протекающие в водородно-кислородном элементе со щелочным электролитом. Скорость ионизации водорода и кислорода на электродах в низкотемпературных элементах повышается за счет применения активных катализаторов. При этом в элементах часто используют пористые металлические и угольные электроды с большой поверхностью пор, в которых катализатор равномерно распределен по поверхности пор. Для увеличения границы соприкосновения трех фаз (газ – электролит – катализатор) диаметр пор должен быть таким, чтобы капиллярное давление P кап в них уравновешивалось избыточным давлением газа P г. Если диаметр поры больше допустимой величины, то Р г > Р кап, и газ барботирует сквозь поры в раствор. Наоборот, очень мелкие поры, когда Р г < Р кап, будут заполняться жидкостью.
При работе элемента водород адсорбируется на сухой стороне отрицательного электрода; под действием катализатора его молекулы диссоциируют. Атомы водорода, хемосорбированные поверхностью, диффундирют к границе электрод – электролит и, проходя сквозь двойной электрический слой, переходят в электролит:
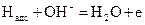
Лучшим катализатором для этой реакции служат металлы платиновой группы и их сплавы. Такие катализаторы относительно стойки к отравляющему действию примесей и поэтому обеспечивают более продолжительную работу электрода. Хорошие результаты получены также при применении в качестве катализатора никеля Ренея и борида никеля.
Процесс, протекающий на положительном электроде, можно изобразить в виде реакции 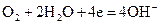
Промежуточные процессы могут изменяться в зависимости от каталитических свойств применяемых электродов. На некоторых катодах кислород адсорбируется на поверхности с одновременной диссоциацией молекул на атомы. Адсорбированный кислород далее восстанавливается:
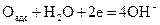
В других случаях, аналогично воздушно-цинковым элементам, сначала проходит восстановление кислорода с образованием перекиси водорода
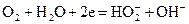
а затем перекись водорода или непосредственно восстанавливается на электроде
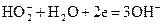
или разлагается в присутствии катализатора с выделением кислорода. Последний вновь участвует в реакции восстановления на катоде.
Ранее, при описании работы воздушно-цинковых элементов, упоминалось о недопустимости накопления в электролите перекиси водорода. При повышении в растворе концентрации перекиси водорода потенциал кислородного электрода падает.
Элемент с металлическими электродами. Важнейшей его частью являются электроды: от их качества в большой мере зависят удельная мощность и к. п. д. элемента. Электрод должен иметь развитую поверхность, поры требуемого размера, малую толщину, высокую каталитическую активность, большую механическую и коррозионную стойкость, хорошую электропроводность и невысокую стоимость.
Активный катализатор в чистом виде обладает недостаточной механической прочностью. Для увеличения прочности были использованы спеченные никелевые пластины, в которых катализатор распределяется по поверхности пор. В качестве катализатора водородного электрода используется никель Ренея, а кислородного — серебро Ренея.
При однослойных электродах значительная часть газа барботирует в раствор, и степень использования топлива в реакции токообразования составляет всего 15%. Чтобы исключить потери газа, электроды снабжены запорным слоем. В этом случае со стороны жидкости электрод имеет дополнительный тонкий слой cпеченного никеля с мелкими порами, в которых капиллярное давление превышает избыточное давление газа. Во время работы эти поры остаются заполненными электролитом. Двухслойный электрод с запорным слоем обеспечивает выход тока, близкий к 100%.
Водородный электрод изготавливается следующим образом. Сплав, содержащий 50% Ni и 50% А1, измельчают и отделяют фракцию порошка с частицами размером 5—10 мкм. Эту фракцию вшивают с карбонильным никелем в соотношении 1: 1. Частицы никеля имеют размер 5 мкм. Полученную массу засыпают в прессформу и на нее наносят тонкий слой карбонильного никеля для образования мелкопористого запорного слоя. Прессование осуществляют при давлении 400 МПа (4000 кгс/см2), а спекание — в течение 30 мин при 700°С в атмосфере, водорода. Спеченные электроды активируют путем анодной поляризации в щелочи при температуре не выше 40 °С. При этом алюминий растворяется и в порах спеченного скелета остается никель Ренея, содержащий небольшое количество алюминия, который поддерживает катализатор в активной форме.
Кислородный электрод готовится аналогичным способом. В отличие от водородного электрода в качестве катализатора здесь применяют серебро Ренея. Исходный сплав для его получения содержит 65% Ag и 35% А1. Кислородные электроды при работе подвергаются заметному коррозионному разрушению. Для повышения стойкости поверхность металла защищают окисной пленкой. Для этой цели электрод пропитывают раствором гидроокиси лития и нагревают на воздухе при 700—800 °С. Происходит поверхностное окисление металла. Ионы лития, внедряясь в кристаллическую решетку окислов никеля, снижают электрическое сопротивление образующегося окисного слоя.
Элементы с описанными электродами могут работать при 30 – 35 °С в течение длительного времени с плотностью тока до 50мA/см2. При 80—90 °С нагрузка может быть увеличена до 100 – 200 мА/см2. Газ поступает в элемент под давлением 0,3 МПа (3 кгс/см2). Электролитом служит 25 – 30%-ный раствор КОН.
Спеченные никелевые электроды имеют толщину 2 – 4 мм. Диффузия газа к электролиту протекает в них с ограниченной скоростью. С целью интенсификации работы элемента предложены более тонкие электроды, которые продолжают усовершенствовать и в настоящее время.
Элементы с угольными электродами. Угольные электроды обладают большой действующей поверхностью, высокой адсорбционной способностью и относительно малой чувствительностью к действию примесей. При равной мощности масса угольных электродов меньше, чем металлических. Электроды могут работать при небольшом давлении и температуре ниже 100 °С.
Угольные электроды применяются в водородно-кислородных элементах с щелочным электролитом. Элемент с трубчатыми электродами, демонстрировавшийся в 1959 г. на Всемирной выставке в Брюсселе, работал при плотности тока 20 мА/см2.
В современных конструкциях применяются плоские электроды. Электропроводной основой в них служит пористая никелевая пластина или проволочная сетка с нанесенным на нее порошком никеля. Во избежание намокания основа пропитана гидрофобизирующим веществом, например политетрафторэтиленом. На основу с одной стороны нанесены два угольных слоя: первый в виде пористого угля, содержащего связующее, и второй — в виде угля, несущего катализатор. В качестве катализатора в кислородном электроде используются серебро и соединения кобальта и алюминия, а в водородном — платина и палладий. Стороной, несущей катализаторный слой, электрод обращен к раствору.
При работе элемента газ проникает через никелевую основу в поры угольного слоя. Здесь он адсорбируется и далее соприкасается с катализатором и электролитом. Благодаря большой удельной поверхности угля и малой толщине электрода (0,5—1 мм) обеспечивается сравнительно высокая скорость электродных процессов.
При кратковременном разряде водородно-кислородные элементы с угольными электродами работают с нагрузкой 500 мА/см2. Режим работы оказывает влияние на срок службы: при разряде элемента при плотности тока 55 мА/см2 напряжение снижается от 0,95 до 0,8 В после 5000 ч работы. Вопрос о создании угольных электродов с длительным сроком службы пока еще не решен.
Топливные элементы с ионообменной мембраной. В таких элементах жидкий электролит заменен твердой ионообменной мембраной. Обычно используются катионообменные мембраны, изготовленные из полимерных материалов, например из сульфированного полистирола или сульфированного смешанного полимера стирола и дивинилбензола и др. Сульфогруппы в таких материалах прочно удерживаются в молекуле, а ионы Н+ способны к обмену, и их подвижность обусловливает проводимость материала. Ионообменная мембрана обладает относительно большим удельным сопротивлением: около 400 Ом·см. Общее сопротивление мембраны вследствие ее малой толщины (десятые доли миллиметра) невелико. Ионообменные мембраны позволяют изготовлять элементы; шириной в несколько миллиметров. Электроды в них одной стороной прижаты непосредственно к мембране, другой — обращены к газовым камерам, где катод омывается кислородом, а анод — водородом. Ток в элементе переносится ионами Н+, и со стороны кислородного электрода образуется вода.
В случае использования анионообменной мембраны перенос тока осуществляется ионами ОН–. Электроды выполняются в виде тонкой титановой, никелевой или платиновой сетки, покрытой платиновой чернью, либо в форме пористой массы, нанесенной на поверхность мембраны. Во втором случае водородный электрод делают из активированного угля, содержащего платину, а кислородный — из угля с добавкой серебра.
Элементы с ионообменной мембраной в 1965 г. были использованы на космических кораблях США. Они были рассчитаны на работу при атмосферном давлении и температуре 60 °С. Разряд элемента происходил при плотности тока 100 мА/см2 и напряжении 0,7 В. Мощность батареи 2 кВ.
Применение твердой мембраны упрощает конструкцию элемента и делает его менее чувствительным к действию двуокиси углерода. В этом случае возможна замена кислорода воздухом. Современные образцы элементов с ионообменной мембраной выдерживают нагрузку 200 мА/см2.
Наряду с ионообменными мембранами представляет интерес использование в элементах псевдотвердых электролитов на неорганической основе. Эти электролиты готовятся в виде матриц из пористого материала, например асбеста, в порах которого содержится жидкий электролит.
Среднетемпературные топливные элементы
Водородно-кислородный элемент со щелочным электролитом. Повышение температуры при разряде водородно-кислородного элемента приводит к заметному увеличению скорости электродных процессов, что позволяет исключить применение в качестве катализаторов металлов платиновой группы.
Элемент, работающий при температуре 200—240 °С и давлении 2—4 МПа (20—40 кгс/см2), был разработан Бэконом, который предложил использовать в элементе двухслойные диффузионные электроды из пористого никеля. Со стороны, обращенной к газу, электроды имеют слой толщиной около 1 мм с порами диаметром 30 мкм, а со стороны электролита — более тонкий слой с порами диаметром до 15 мкм. При избыточном давлении 0,01 МПа газ вытесняет электролит из крупных пор, однако он не может преодолеть высокое капиллярное давление в запорном слое. Электроды были изготовлены из карбонильного никеля. Порошок никеля (80%) смешивали с углекислым аммонием (20%), слегка спрессовывали и подвергали спеканию в восстановительной атмосфере. Затем на него наносили слой суспензии из карбонильного никеля для образования запорного слоя и электрод вторично спекался.
Для повышения активности и коррозионной стойкости электроды подвергались дополнительной обработке. Водородный электрод пропитывали раствором азотнокислого никеля и прокаливали. При этом на его поверхности образовывался осадок окиси никеля, который далее восстанавливался до металла. Кислородный электрод обрабатывали раствором, содержащим нитраты никеля и лития. При прокаливании на электроде образовывался никелат лития, защищавший металл от коррозии.
Лучшие результаты в работе элемента были получены при температуре 200 °С, давлении 2,8 МПа (28 кгс/см2) и применении в качестве электролита 37%-ного раствора едкого кали. Э. д. с. элемента 1,04 В. Рабочее напряжение зависит от токовой нагрузки:
| Плотность тока, мА/см2 | 107,6 | |||
| Напряжение, В | 1,005 | 0,885 | 0,715 | 0,68 |
Напряжение практически определяет к. п. д. элемента, так как выход тока при работе близок к 100%. С увеличением интенсивности разряда уменьшается срок службы элемента.
Необходимость поддержания в элементе Бэкона высокого давления усложняет его устройство. Более поздние исследования были посвящены снижению рабочего давления в элементе. Так, были созданы элементы, работающие при 200–260 °С и давлении не выше 0,4 МПа (4 кгс/см2). В этих элементах применяются двухслойные электроды, но в качестве электролита используется 85%-ный раствор КОН, обладающий высокой температурой кипения. Элемент работает при плотности тока 130 мА/см2, но допускает непродолжительную перегрузку до 330 мА/см2. К. п. д. элемента – 75%, срок службы – более 2000ч.
В процессе усовершенствования водородных электродов представляет интерес применение тонких фольговых электродов. При повышении температуры водород сравнительно легко диффундирует сквозь такие электроды. Двуокись углерода и другие примеси, наоборот, не могут проникнуть к электролиту. Для изготовления фольговых электродов рекомендуется сплав, содержащий 75% Pd и 25% Ag.
Тема 9 (2 часа). Электрохимические преобразователи информации
Лекция 17. Хемотроника. Датчики (сенсоры), их классификация. Химические сенсоры (устройство и принцип работы). Электрохимические сенсоры: потенциометрические, амперометрические, кондуктометрические, кулонометрические. Биосенсоры.
В настоящее время прогресс во всех областях науки и техники неразрывно связан; а порой и обусловлен успехами в области электроники, автоматики и вычислительной техники.
К автоматическим устройствам и системам, применяемым как в простейших бытовых приборах, так и в сложнейшей системе управления космическим кораблем, предъявляются самые разнообразные требования. Эти требования могут быть удовлетворены не только путем совершенствования уже существующих технических средств автоматики и электроники, но и путем разработки новых средств на основе использования последних достижений физики, химии и других отраслей знания.
Потребности в новых элементах для построения автоматических систем контроля и управления стимулировали развитие нового научного направления по использованию электрохимических явлений для создания различного рода преобразователей информации. Это направление, возникшее на стыке автоматики и электроники с электрохимией и получившее название химо-тропики, разрабатывает основы действия и принципы построения электрохимических преобразователей информации, а также способы применения этих приборов.
Строго говоря, использование электрохимических явлений в средствах автоматики, контроля и управления не является новым. Достаточно указать на нашедшие широкое применение кондуктометрические, потенциометрические, полярографические и другие электрохимические методы контроля производственных процессов. Хорошо известны рН-метры, электрохимические счетчики ампер-часов и т. п. Однако эти примеры не исчерпывают всех возможностей создания приборов на электрохимической основе. В последнее время на основе успехов в развитии теоретической электрохимии созданы новые электрохимические преобразователи самого различного назначения: датчики температуры, механических и акустических воздействий, интеграторы, управляемые сопротивления, оптические модуляторы, выпрямители и стабилизаторы микротоков, нелинейные емкости, генераторы колебаний тока и напряжения, индикаторы отказа электронных схем, умножители, дифференцирующие устройства, усилители постоянного тока и т. п.
В зарубежной литературе упомянутые приборы получили различные названия: солионы, овитроны, мемисторы, хронисторы и т. п. Название «электрохимические преобразователи информации» подчеркивает, что в основу действия этих приборов положены явления и закономерности, наблюдаемые при протекании электрохимических процессов.
Предварительные результаты исследований электрохимических преобразователей показывают, что они могут быть эффективно использованы для преобразования маломощных сигналов в области низких и инфранизких частот. В этой области некоторые электрохимические элементы по простоте устройства, стоимости, чувствительности и потребляемой мощности имеют заметные преимущества перед приборами аналогичного назначения, построенными на других физических принципах. Свойства и технические параметры электрохимических преобразователей информации в существенной степени обусловлены характером процессов, в них протекающих.
Основным элементом любого электрохимического преобразователя является электрохимическая ячейка. В простейшем виде она представляет собой заполненный раствором электролита сосуд с погруженными в него двумя металлическими электродами. Электрический ток пересекает границы электрод — раствор и раствор — электрод, при этом меняется природа носителей тока. Переход электрического тока через межфазные границы происходит в результате химических реакций, сопровождающихся передачей электронов от электрода ионам раствора и от ионов раствора электроду. Иногда, наряду с ионами раствора, в электрохимической реакции участвуют нейтральные молекулы или атомы, также способные пересекать границы раздела фаз.
Напоминаю, что процесс передачи электрона от электрода ионам раствора называется катодным электрохимическим процессом, а электрод, на котором он происходит,— катодом. Процесс, сопровождающийся передачей электронов от ионов раствора электроду, называется анодным электрохимическим процессом, а электрод, на котором он происходит,— анодом. В результате катодных процессов происходит восстановление, а в результате анодных — окисление участвующих в электродных процессах веществ.
Электрохимический диод. Электрохимический диод представляет собой герметичную электрохимическую ячейку с двумя инертными металлическими электродами различной поверхности (рис.1). Ячейка заполнена электролитом, содержащим окисленные и восстановленные формы ионов, например, J-3/J-; Fe (CN)63-/Fe (CN)64-, Fe3+/Fe2+.Ее корпус может быть изготовлен из любого изоляционного химически стойкого материала, например, из стекла, пластмассы.
|
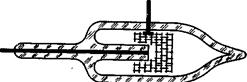 Электроды ячейки образуют с электролитом обратимую окислительно-восстановительную систему. Как отмечалось в первой главе, ток, протекающий через такой элемента, будет определяться закономерностями диффузионной кинетики, т. е. величина тока в основном будет зависеть от условий подвода вещества к электроду и отвода продуктов реакции от электрода.
Электроды ячейки образуют с электролитом обратимую окислительно-восстановительную систему. Как отмечалось в первой главе, ток, протекающий через такой элемента, будет определяться закономерностями диффузионной кинетики, т. е. величина тока в основном будет зависеть от условий подвода вещества к электроду и отвода продуктов реакции от электрода.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!