
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Абсорбция
|
|
|
|
Абсорбцией называется процесс поглощения газа или пара жидким поглотителем (абсорбентом). Обратный процесс — выделение поглощенного газа из поглотителя — называется десорбцией.
В промышленности абсорбция с последующей десорбцией широко применяется для выделения из газовых смесей ценных компонентов (например, для извлечения из коксового газа аммиака, бензола и др.), для очистки технологических и горючих газов от вредных примесей (например, при очистке их от сероводорода), для санитарной очистки газов (например, отходящих газов от сернистого ангидрида) и т. д.
Равновесие при абсорбции
Подобно тому как передача тепла протекает лишь при отклонении от состояния равновесия, т. е. при наличии разности температур между теплоносителями, так и переход вещества из одной фазы в другую происходит при отсутствии равновесия между фазами.
Пусть имеются две фазы G и L, причем распределяемое вещество вначале находится только в первой фазе G и имеет концентрацию У. Если привести фазы в соприкосновение, то распределяемое вещество начнет переходить в фазу L. С момента появления распределяемого вещества в фазе L начнется и обратный переход его в фазу G.
Скорость обратного перехода будет увеличиваться по мере повышения концентрации распределяемого вещества в фазе L. В некоторый момент скорости перехода вещества из фазы и обратно станут одинаковыми. При этом установится состояние равновесия между фазами, при котором явного переноса вещества из одной фазы в другую происходить не будет. В состоянии равновесия существует определенная зависимость между концентрациями распределяемого вещества в этих фазах. Т. е. при Р-const и t-const,
|
|
|
x*=f(y) y*=f(x)
x* и y* - равновесные концентрации распределенного вещества соответственно в жидкой и газовой фазе.
Существует следующая зависимость:
y*=mx m=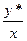
Однако чаще всего: y*=m'xn
m'=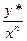 , где
, где
m и m' – коэффициенты распределения
y m'xn - кривые распределения
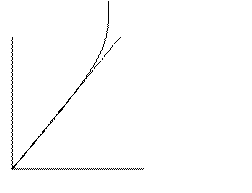 x
x
Порциальное давление компонента подчиняется закону Дальтона:
Р=Робщ - закон Дальтона
- закон Дальтона
Растворимость газов в жидкостях зависит от свойств и жидкости, от температуры и парциального давления растворяющегося газа (компонента) в газовой смеси.
Зависимость между растворимостью газа и его парциальным давлением характеризуется законом Генри, согласно которому равновесное парциальное давление р* пропорционально содержанию растворенного газа в растворе X (в кг/кг поглотителя):
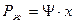 ,
,
где Ψ - коэффициент пропорциональности, имеющий размерность давления и зависящей от свойств растворенного газа и поглотителя и от температуры (Приложение XVI).
х- концентрация компонента, кг/кг поглотителя
В усложненных условиях (хемосорбция, хорошая растворимость газов) растворимость многих газов значительно отклоняется от закона Генри и приходится пользоваться экспериментальными данными.
Для протекания процесса необходима движущая сила:
ΔР=Рг-Рж
Рг>Рж – абсорбция
Рг<Рж – десорбция
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 423; Нарушение авторских прав?; Мы поможем в написании вашей работы!