
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрический момент диполя связи. Полярные и неполярные молекулы
|
|
|
|
При образовании КС между атомами одинаковой химической природы (например, в молекулах Н2, Cl2, О2) общее электронное облако располагается в пространстве между ядрами симметрично. Такую КС называют неполярной. Если же связь образуют атомы разных элементов, то общие электроны смещаются в сторону атома с большим значением ЭО и такую КС называют полярной. Смещение электронной плотности в область более электроотрицательного элемента приводит к возникновению в его околоядерном пространстве эффективного отрицательного заряда q –, и, наоборот, недостаток электронной плотности у взаимодействующего с ним атома ведет к появлению эффективного положительного заряда q +. Такая система представляет собой электрический диполь, поэтому мерой полярности КС является величина электрического момента диполя (ЭМД) связи mА–В, Кл×м, которую можно оценить по формуле
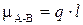 (16)
(16)
где l – длина диполя. При оценочных расчетах длину диполя можно принимать равной длине связи.
ЭМД можно также выражать в дебаях, D: 1 D = 3,33×10-30 Кл × м.
Полярную КС характеризуют при помощи степени ионности (СИ) и степени ковалентности (СК) связи, которые в сумме составляют 100 % (СИ + СК = 100 %). СИ показывает долю (%) смещенности общей электронной пары в область атома с большим значением ЭО. Ее можно оценить по формуле
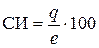 % (17)
% (17)
где е – заряд электрона (е = 1,602×10-19 Кл).
Из уравнения (17) следует, что с увеличением DЭО взаимодействующих атомов СИ связи увеличивается, а СК связи уменьшается. Количественная связь между СИ и DЭО приведена на рис.1.
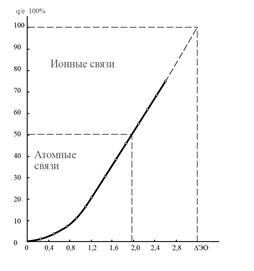
Рис. 1. Зависимость СИ от ΔЭО.
mА–В – величина векторная, направленная от положительного полюса диполя к отрицательному. Например, в молекуле HF mН®F будет направлен от атома водорода к атому фтора, так как ЭО(F) > ЭО(Н).
|
|
|
Молекулы с полярными КС в зависимости от распределения суммарной электронной плотности всех связей в молекуле могут быть полярными и неполярными. Молекула считается неполярной, если ЭМД молекулы m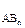 , который определяется путем геометрического сложения ЭМД всех ее связей, равен нулю.
, который определяется путем геометрического сложения ЭМД всех ее связей, равен нулю.
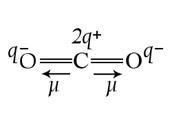
Например, в молекуле СО2 (см. рис.2а), которая имеет симметричное линейное строение, ЭМД отдельных связей направлены в противоположные стороны и при их геометрическом сложении полностью компенсируют друг друга. Поэтому m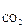 = 0 и молекула СО2 является неполярной.
= 0 и молекула СО2 является неполярной.
В полярной молекуле m 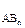 > 0, то есть геометрическое сложение векторов ЭМД связей дает конечный вектор m
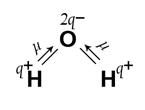
> 0, то есть геометрическое сложение векторов ЭМД связей дает конечный вектор m 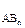 . Например, в угловой молекуле Н2О (см. рис.2б) полярные связи располагаются под углом 104,5°. При геометрическом сложении ЭМД связей не происходит их взаимной компенсации (m
. Например, в угловой молекуле Н2О (см. рис.2б) полярные связи располагаются под углом 104,5°. При геометрическом сложении ЭМД связей не происходит их взаимной компенсации (m 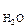 > 0, молекула полярная).
> 0, молекула полярная).
а) б)
Рис.2. Векторное сложение ЭМД на примере молекул Н2О и СО2.
В табл. 6 приведены предполагаемые полярности молекул различной геометрической формы.
Таблица 6
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 835; Нарушение авторских прав?; Мы поможем в написании вашей работы!