
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Комплексные соединения. Основные виды межмолекулярного взаимодействия
|
|
|
|
Основные виды межмолекулярного взаимодействия. Донорно-акцепторная связь. Комплексные соединения. Комплексы, комплексообразователи, лиганды, заряд и координационное число комплексов.
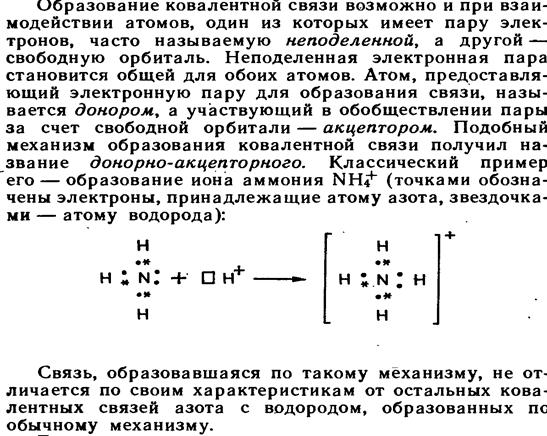
5.1. Основные виды межмолекулярного взаимодействия. Между молекулами может осуществляться как электростатическое, так и донорно-акцепторное взаимодействие.



5.2.Донорно–акцепторный механизм
ковалентной связи



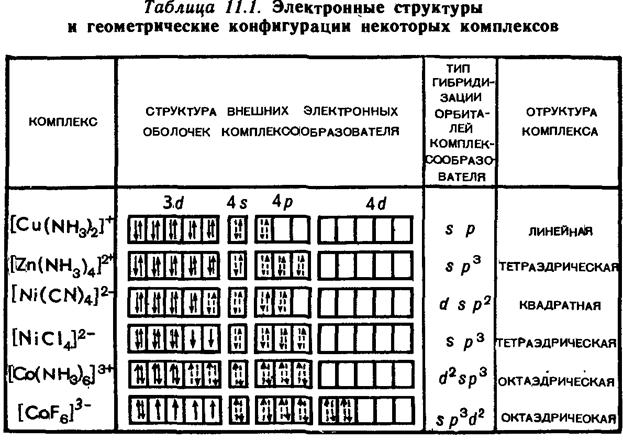
Во внешнюю сферу входят катионы или анионы. Комплексные соединения неэлектролиты не имеют внешней сферы, например, [Pt(NH3)2Cl4]. Типичными комплексообразователями являются d-элементы: Ag+,Au+,Cu+, Cu2+, Hg2+,Cd2+,Zn2+,Fe2+, Fe3+, Co2+,Ni2+, Pt4+ и другие, а также s,p – элементы (Ве, Al, Sn, Pb). Важнейшими лигандами являются:
1) нейтральные молекулы, имеющие дипольный момент: Н2О, NН3, СО, NО и другие;
2) ионы СN-, NО2-, Сl-, Br-,J-, S2O32-, ОН-, СО32- и другие.
Значения координационного числа (КЧ) для некоторых ионов комплексообразователей приведены в таблице:
| КЧ=2 | КЧ=4 | КЧ=6 | КЧ=8 |
| Ag+,Au+,Cu+ | Cu2+, Hg2+,Cd2+, Ве2+,Al3+, Pt2+ | Zn2+,Fe2+,Fe3+, Co2+,Ni2+,Pt4+,Сr 3+ | Cа2+, Ва2+, Sr2+, Ti4+ |
Как видно. чаще всего координационное число имеет значения 4 и 6. Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов. При этом заряд комплексообразователя принимается равным его степени окисления. Вследствие того, что любое комплексное соединение в целом электронейтрально, алгебраическая сумма зарядов внешней и внутренней сфер комплексного соединения равна нулю.
Пример 1. Вычислить заряды следующих комплексных ионов, образованных хромом (III): а)[CrCl(H2O)5]; б) [CrCl2(H2O)4]; в) [Cr(C2О4)2(H2O)2].
Решение. Заряд иона хрома (III) принимаем равным +3, заряд молекулы воды равен нулю, заряды хлорид- и оксалат-ионов соответственно равны -1 и -2. Составляем алгебраические суммы зарядов для каждого из указанных соединений:а)+3 + (-1) =+2; б)+3 +2(-1) = +1; в)+3 +2(-2) = -1.
|
|
|
Названия комплексных солей образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже. Название комплексного катиона составляют следующим образом: сначала указывают числа (используя греческие числительные: ди, три, тетра, пента, гекса и т.д.) и названия нейтральных лигандов, причем вода называется аква, а аммиак – аммин; Затем указывают числа и названия отрицательно заряженных лигандов с окончанием «о»(Cl- - хлоро, SO42- -сульфато, ОН—гидроксо и т.д.); последним называют комплексообразователь, указывая его степень окисления (в скобках римскими цифрами после названия комплексообразователя).
Пример 2. Назвать комплексные соли: [СоBr(NH3)5]SO4, Ва[Сr(SСN)4(NH3)2].
Решение: [PtCl(NH3)3]Cl –; [СоBr(NH3)5]SO4 – сульфат пентамминбромокобальта (III); Ва[Сr(SСN)4(NH3)2] –диамминтетрароданохромат (III) бария.


5.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 671; Нарушение авторских прав?; Мы поможем в написании вашей работы!