
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика гальванического элемента
|
|
|
|
На Е влияют следующие факторы: температура, природа реагирующих веществ, концентрация реагирующих веществ.1. Природа реагирующих веществ:
1) 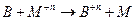
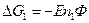 n – валентность, Ф – число Фарадея
n – валентность, Ф – число Фарадея
2) 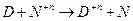
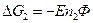 Работе противостоит сила внешнего давления.
Работе противостоит сила внешнего давления.
2.Влияние температуры на Э.Д.С.
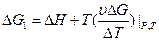
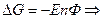
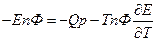
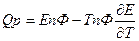
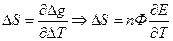 - изменение энтропии. Если
- изменение энтропии. Если 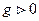 то
то 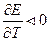 Если
Если 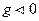 то
то 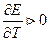
3. Зависимость Е от концентрации
Пусть в гальваническом элементе протекает реакция следующего типа:
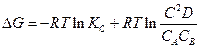 где С – концентрация
где С – концентрация
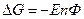 левую и правую части делим на
левую и правую части делим на 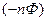
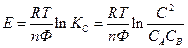
Если температура постоянная, то 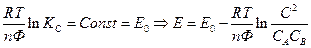
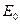 - стандартная Э.Д.С., соответствующая тому простому случаю, когда
- стандартная Э.Д.С., соответствующая тому простому случаю, когда 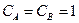
Для стандартных условий: Т=298 К, р=1атм 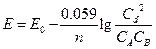 - уравнение Нериста для гальванического элемента. Ф = 96500
- уравнение Нериста для гальванического элемента. Ф = 96500 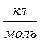
14.5. Водородный электрод сравнения и измерение ЭДС.. Водородный электрод сравнения удобен тем, что стандартный электродный потенциал водорода равен нулю. φ02H+|H2= 0,00В.Водородный электрод представляет собой сосуд, в котором находится H2SO4 с концентрацией [H+] = 1 моль/л. Электрод выполняется из платины, которая сверху покрыта слоем рыхлой платины. Платина, особенно рыхлая, является прекрасным адсорбентом газообразного водорода. Извне в этот сосуд подается газообразный водород под давлением в 1атм. Платиновый электрод поглощает водород и практически становится водородным электродом. Электроды сравнения необходимы по той причине, что не существует методов непосредственного измерения электродных потенциалов. Возможно только измерение ЭДС гальванического элемента и вычисление неизвестного потенциала по известному. Для определения потенциалов электродов по водородной щкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым –стандартный водородный электрод с электродом из того металла, потенциал которого необходимо измерить.
|
|
|
Измерение ЭДС данного гальванического элемента производится компенсационным методом. Схема включает в себя реохорд, рис.3.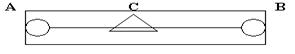
Реохорд - длинная деревянная линейка, по краям которой находятся металлические зажимы, между зажимами туго натянута стальная струна определенного сопротивления. По струне перемещается металлический движок. В схему включены аккумулятор и гальванометр. Движок реохорда перемещают до тех пор, пока стрелка гальванометра не остановится на нуле. Это - состояние компенсации, для которого справедливо соотношение:
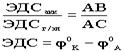 ,где ЭДСакк- ЭДС аккумулятора, ЭДСг/эл - ЭДС гальванического элемента, AB - длина линейки, AC - расстояние до движка (состояние компенсации).
,где ЭДСакк- ЭДС аккумулятора, ЭДСг/эл - ЭДС гальванического элемента, AB - длина линейки, AC - расстояние до движка (состояние компенсации).
14.6.Потенциал редокси-электродов. 

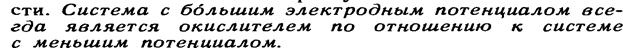
Концентрационные гальванические элементы
Особенностью концентрационного гальванического элемента является то, что оба электрода выполнены из одного и того же метала. Эти электроды отличаются друг от друга только концентрациями солевых растворов.
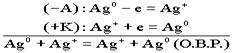 . По формуле Нерста рассчитаем ЭДС концентрационного элемента.
. По формуле Нерста рассчитаем ЭДС концентрационного элемента. 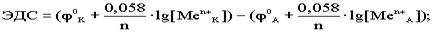
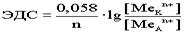 Недостатки концентрационных гальванических элементов: разрушаемый анод, малая ЭДС. Концентрационные элементы используются в тех случаях, где необходима малая ЭДС. Окислительно - восстановительные (ОВ) гальванические элементы: Особенностью данных элементов является то, что окислительно - восстановительный процесс протекает только в растворах. Оба электрода являются инертными, или пассивными, т.е. сами они не принимают участия в ОВ процессах, а выполняют роль проводников электронов.
Недостатки концентрационных гальванических элементов: разрушаемый анод, малая ЭДС. Концентрационные элементы используются в тех случаях, где необходима малая ЭДС. Окислительно - восстановительные (ОВ) гальванические элементы: Особенностью данных элементов является то, что окислительно - восстановительный процесс протекает только в растворах. Оба электрода являются инертными, или пассивными, т.е. сами они не принимают участия в ОВ процессах, а выполняют роль проводников электронов. 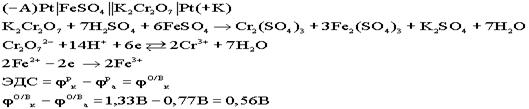
Топливные элементы(ТЭ) Электрохимические реакции очень медленные. Для ускорения процессов советский инженер Давтян предложил ввести в окислительно – восстановительные гальванические элементы катализаторы. Суть топливных элементов заключается в том, что электроды являются одновременно и катализаторами. Топливо, т.е. восстановитель и окислитель, хранится вне гальванических элементов и подаётся на электроды по мере необходимости, рис.2.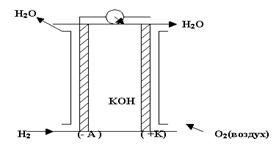 Электроды выполняются из пористого Ni или пористой Pt, то есть тех металлов, которые являются катализаторами электродных процессов. В качестве электролита используется раствор гидроксида калия.
Электроды выполняются из пористого Ni или пористой Pt, то есть тех металлов, которые являются катализаторами электродных процессов. В качестве электролита используется раствор гидроксида калия.
Схема кислородно- водородного ТЭ может быть записана в виде: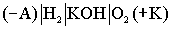 .
.
|
|
|
На аноде элемента протекает реакция окисления водорода:
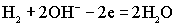 .На катоде восстанавливается кислород:
.На катоде восстанавливается кислород:
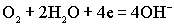 .Суммированием анодной и катодной реакций получаем уравнение токообразующей реакции:
.Суммированием анодной и катодной реакций получаем уравнение токообразующей реакции: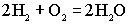 ,в результате которой химическая энергия непосредственно превращается в электрическую.Пример применения топливных элементов - использование их в мобильниках фирмы Toshiba.
,в результате которой химическая энергия непосредственно превращается в электрическую.Пример применения топливных элементов - использование их в мобильниках фирмы Toshiba.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1528; Нарушение авторских прав?; Мы поможем в написании вашей работы!