
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамические потенциалы и условия равновесия
|
|
|
|
Все расчеты в термодинамике основываются на использовании функций состояния, называемых термодинамическими потенциалами. Каждому набору независимых параметров соответствует свой термодинамический потенциал. Изменения потенциалов, происходящие в ходе каких-либо процессов, определяют либо совершаемую системой работу, либо получаемое системой тепло.
При рассмотрении термодинамических потенциалов мы будем пользоваться соотношением
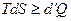 . (5.30)
. (5.30)
Знак равенства относится к обратимым, знак неравенства — к необратимым процессам.
Термодинамические потенциалы являются функциями состояния. Поэтому приращение любого из потенциалов равно полному дифференциалу функции, которой он выражается. Полный дифференциал функции f (х, у) переменных x и у определяется выражением
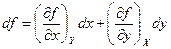 .
.
Поэтому, если в ходе преобразований мы получим для приращения некоторой величины f выражение вида
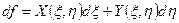 ,
,
можно утверждать, что эта величина является функцией параметров ξ и η, причем функции X (ξ, η) и Y (ξ, η) представляют собой частные производные функции f (ξ, η):
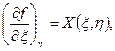
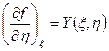 .
.
Внутренняя энергия. С одним из термодинамических потенциалов мы уже хорошо знакомы. Это — внутренняя энергия системы. Выражение первого начала для обратимого процесса можно представить в виде

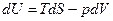 .
.
В качестве так называемых естественных переменных для потенциала U выступают переменные S и V, поэтому
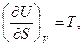
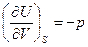 .
.
Из первого начала термодинамики d'Q = dU + d'A следует, что в случае, когда тело не обменивается теплом с внешней средой, совершаемая им работа равна
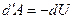 ,
,
или в интегральной форме:
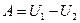 .
.
Таким образом, при отсутствии теплообмена с внешней средой, работа равна убыли внутренней энергии тела.
|
|
|
При постоянном объеме
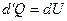 .
.
Следовательно, теплоемкость при постоянном объеме равна
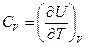 .
.
Свободная энергия. Работа, производимая телом при обратимом изотермическом процессе, может быть представлена в виде
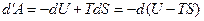 . (5.31)
. (5.31)
Функцию состояния
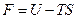
называют свободной энергией тела. Таким образом, при обратимом изотермическом процессе работа равна убыли свободной энергии тела:
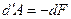 ,
,  (5.32)
(5.32)
или
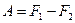 (T = const, обр.). (5.33)
(T = const, обр.). (5.33)
При изотермических процессах свободная энергия играет такую же роль, как внутренняя энергия при адиабатических процессах. Формула (5.32) справедлива как при обратимых, так и при необратимых процессах. Формула же (5.33) справедлива только для обратимых процессов. При необратимых процессах d'Q < ТdS. Подставив это неравенство в соотношение d'A = d'Q - dU, легко получить, что при необратимых изотермических процессах
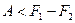 (T = const, необр.).
(T = const, необр.).
Следовательно, убыль свободной энергии определяет верхний предел количества работы, которую может совершить система при изотермическом процессе.
Возьмем дифференциал от функции F:
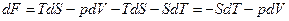 .
.
Естественными переменными для свободной энергии являются Т и V, очевидно
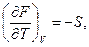
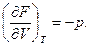
Заменим в (5.31) d'Q =dU + p dV и разделим получившееся соотношение на dt (t – время). В результате получим, что
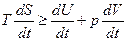 . (5.34)
. (5.34)
Если температура и объем остаются постоянными, то соотношение (5.34) может быть преобразовано к виду
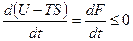
 (T = const, V = const). (5.35)
(T = const, V = const). (5.35)
Из этой формулы следует, что необратимый процесс, протекающий при постоянных температуре и объеме, сопровождается уменьшением свободной энергии тела. По достижении равновесия F перестает меняться со временем. Таким образом, при неизменных Т и V равновесным является состояние, для которого свободная энергия минимальна.
Энтальпия. Если процесс происходит при постоянном давлении, то количество получаемого телом тепла можно представить следующим образом:
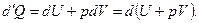 (5.36)
(5.36)
Функцию состояния
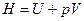 (5.37)
(5.37)
называют энтальпией или тепловой функцией.
|
|
|
Из (5.36) и (5.37) вытекает, что количество тепла, получаемого телом в ходе изобарического процесса, равно
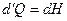 , (5.38)
, (5.38)
или в интегральной форме
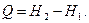 (5.39)
(5.39)
Следовательно, в случае, когда давление остается постоянным, количество получаемого телом тепла равно приращению энтальпии.
Дифференцирование выражения (5.37) дает
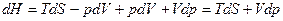
- энтальпия есть термодинамический потенциал в переменных S и р. Его частные производные равны
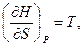
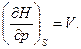
В соответствии с (5.38) теплоемкость при постоянном давлении равна 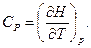
Из полученных соотношений следует, что при постоянном давлении энтальпия обладает свойствами, аналогичными тем, какие имеет внутренняя энергия при постоянном объеме.
Термодинамический потенциал Гиббса. Так называется функция состояния, определяемая следующим образом:
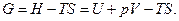
Ее полный дифференциал равен
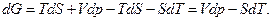
Следовательно, естественными переменными для функции G являются р и Т. Частные производные этой функции равны
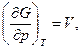
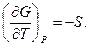
Если температура и давление остаются постоянными, соотношение (5.34) можно записать в виде:
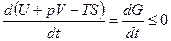 (T = const, p = const). Из этой формулы следует, что необратимый процесс, протекающий при постоянных температуре и давлении, сопровождается уменьшением термодинамического потенциала Гиббса. По достижении равновесия G перестает изменяться со временем. Таким образом, при неизменных Т и р равновесным является состояние, для которого термодинамический потенциал Гиббса минимален. В табл. 1 приведены основные свойства термодинамических потенциалов.
(T = const, p = const). Из этой формулы следует, что необратимый процесс, протекающий при постоянных температуре и давлении, сопровождается уменьшением термодинамического потенциала Гиббса. По достижении равновесия G перестает изменяться со временем. Таким образом, при неизменных Т и р равновесным является состояние, для которого термодинамический потенциал Гиббса минимален. В табл. 1 приведены основные свойства термодинамических потенциалов.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 1625; Нарушение авторских прав?; Мы поможем в написании вашей работы!