
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
VI Равновесие в гетерогенных системах
|
|
|
|
В системах, содержащих две и более фаз, как например газ и твердое вещество, раствор и осадок, относительная концентрация вещества в чистой твердой фазе остается постоянной, и равной 1. Если на дне стакана с раствором имеется кристаллическая соль, то по мере ее растворения масса кристаллов уменьшается, но концентрация соли в самих кристаллах остается постоянной. Поэтому насыщенный раствор соли (что соответствует состоянию равновесия раствор – осадок) имеет концентрацию, не зависящую от массы осадка.
Постоянная концентрация вещества в твердой фазе, принимаемая равной 1, в выражение П с и K не входит. Распространенным примером гетерогенных процессов является растворение малорастворимых солей и выпадение осадков из растворов:
прямая реакция растворение
 СаСО3(кр) Са2+ + СО32-
СаСО3(кр) Са2+ + СО32-
K пр = 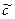 (Ca2+)×
(Ca2+)×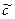 (CO32-)
(CO32-)
Эту константу равновесия называют константой растворимости, или еще произведением растворимости.
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 754; Нарушение авторских прав?; Мы поможем в написании вашей работы!