
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплопроводность
|
|
|
|
Jm1-поток массы
D-коэффициент диффузии
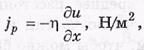
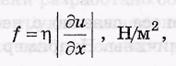
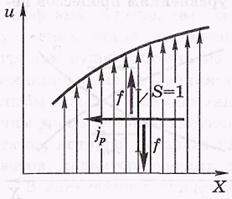 Внутреннее трение.
Внутреннее трение.
f-поток импульса.
-n-коэффициент вязкости
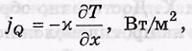
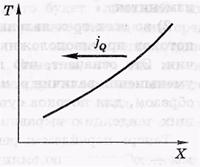
-jQ-поток гелия
–N-коэффицент теплороводности.
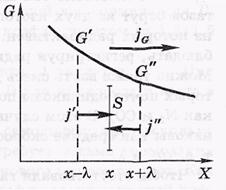
Общее уравнение переноса.Величина G характеризует определенное молекулярное свойство, отнесенное к одной молекуле. Это может быть энергия, импульс, электрический заряд итд. При наличии градиента величины G должен возникнуть поток в сторону ее уменьшения.
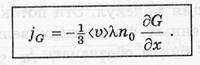 - <v>-средн скорость
- <v>-средн скорость
- n0- концентрация.
- jG- поток величины G
- λ- длина свободного.
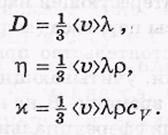
С V -теплоемкость при постоянном объеме.
Уравнения переноса, зависящие от времени.:
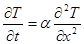
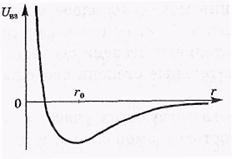
Реальный газ.
Уравнение Ван-дер-Ваальса
R0-собственный радиус молекулы.
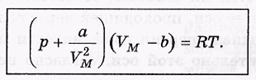
-уравнения для моля V-объем 1моля.
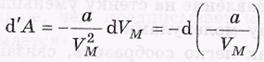 Энергия ван-дер-вальсовского газа
Энергия ван-дер-вальсовского газа
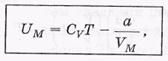
-для одного моля.
где Cv =(i/2)R- число степеней свободы
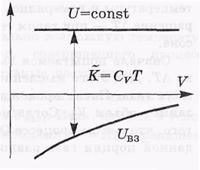
Если газ расширяется в пустоту без теплообмена с окружающими телами, то А = 0, Q = 0, и согласно первому началу в этом процессе U = const. Значит, с ростом объема температура газа уменьшается (в отличие от идеального газа).
Это можно представить и наглядно на рисунке. Видно, что при расширении газа (увеличении объема V) в случае U = const суммарная кинетическая энергия молекул газа, а значит и температура Т, уменьшается. Газ охлаждается.
Эффект Джоуля—Томсона. Исследования Джоуля и Томсона позволили не только экспериментально подтвердить зависимость внутренней энергии реального газа от его объема. Было открыто важное физическое явление, получившее название эффекта Джоуля-Томсона.
В их опытах использовалась теплоизолированная трубка, в середине которой помещалась пористая перегородка N.
|
|
|
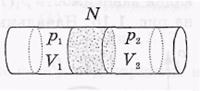
Исследуемый газ под действием перепада давлений (p1>p2) медленно протекал через перегородку. Благодаря медленности течения кинетическая энергия газа как целого практически не менялась. В этих условиях газ в каждый момент по обе стороны перегородки находился в термодинамически равно
весных состояниях. Теплоизолированность
трубки делала процесс течения адиабатическим. Давления газа по обе стороны перегородки (p1 и р2) поддерживались постоянными.
При стационарном течении с одной стороны перегородки устанавливалась постоянная температура Т1, а с другой стороны — Т2. Эти температуры и измерялись в опытах. Изменение температуры — приращение  T — при таком течении и называют эффектом Джоуля-Томсона.
T — при таком течении и называют эффектом Джоуля-Томсона.
Сначала попытаемся выяснить, что можно ожидать относительно 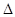 T. Для этого мысленно выделим слева от перегородки объем V1 моля газа. После прохождения через перегородку эта порция газа займет объем V2. Согласно 1-му началу термодинамики с учетом того, что в этом процессе Q = 0, приращение внутренней энергии
T. Для этого мысленно выделим слева от перегородки объем V1 моля газа. После прохождения через перегородку эта порция газа займет объем V2. Согласно 1-му началу термодинамики с учетом того, что в этом процессе Q = 0, приращение внутренней энергии 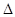 U данной порции газа равно работе А' внешних сил:
U данной порции газа равно работе А' внешних сил:
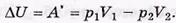
При малом перепаде давлений
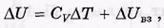
где  U вз — приращение энергии взаимодействия моля молекул газа. Имея в виду, что
U вз — приращение энергии взаимодействия моля молекул газа. Имея в виду, что  U = А', получим из двух предыдущих формул, что
U = А', получим из двух предыдущих формул, что
Из этой формулы следует, что эффект (знак 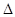 T) зависит от соотношения между приращением внутренней энергии
T) зависит от соотношения между приращением внутренней энергии  U, равной работе
U, равной работе
внешних сил, и приращением энергии
взаимодействия  Uвз. Это поясняет рисунок,
Uвз. Это поясняет рисунок,
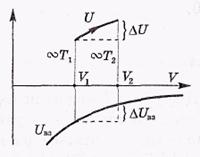
где величина вертикального отрезка характеризует собственную кинетическую энергию газа К, а значит и температуру Т. В частности, если  U =
U = 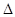 Uвз, то
Uвз, то 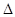 T = 0.
T = 0.
Довольно громоздкий расчет дает возможность найти зависимость давления р1 от Т1 при которых эффект (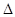 T) равен нулю. Соответствующая зависимость р1(T1) — ее называют кривой инверсии — показана на рисунке.
T) равен нулю. Соответствующая зависимость р1(T1) — ее называют кривой инверсии — показана на рисунке.
|
|
|
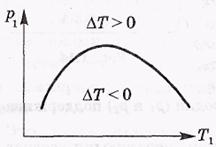
Начальные состояния (р1Т1) под кривой инверсии приводят к положительному эффекту Джоуля-Томсона, т. е. к охлаждению газа (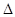 T < 0), Кривая инверсии не является универсальной, она своя для каждого газа, поскольку расчетная формула для
T < 0), Кривая инверсии не является универсальной, она своя для каждого газа, поскольку расчетная формула для 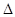 T зависит от постоянных а и b Ван-дер-Ваальса.
T зависит от постоянных а и b Ван-дер-Ваальса.
|
|
|
|
|
Дата добавления: 2014-01-03; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!