
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие реакции анионов
|
|
|
|
| Реактивы | Анионы I группа: | ||||||
| SO42– | SO32– | CO32– | PO43– | ||||
| BaCl2 в нейтральной среде | Белый осадок ВаSO4 | Белый осадок ВаSO3 | Белый осадок ВаSO3 | Белый осадок ВаHPO4 | |||
| BaCl2 в кислой среде | ВаSO4 | ― | ― | ― | |||
| AgNО3 в азотно-кислой среде | ― | ― | ― | ― | |||
| AgNО3 в нейтральной среде | Белый осадок Ag2SO4 | Белый осадок Ag2SO3 | Белый осадок Ag2CO3 | Желтый осадок Ag3PO4 | |||
| H2SO4 | ― | Выделение SO2 | Выделение СО2 | ― | |||
| Реактивы | Анионы II группа | ||||||
| Cl– | Br– | I– | |||||
| BaCl2 в нейтральной среде | ― | ― | ― | ||||
| BaCl2 в кислой среде | ― | ― | ― | ||||
| AgNО3 в азотно-кислой среде | Белый осадок AgCl | Светло-желтый осадок AgBr | Желтый осадок AgI | ||||
| AgNО3 в нейтральной среде | AgCl | AgBr | AgI | ||||
| H2SO4 | ― | ― | ― | ||||
| Реактивы | Анионы III группа | ||||||
| NO3– | CH3COOH– | ||||||
| BaCl2 в нейтральной среде | ― | ― | |||||
| BaCl2 в кислой среде | ― | ― | |||||
| AgNО3 в азотно-кислой среде | ― | XX | |||||
| AgNО3 в нейтральной среде | ― | ― | |||||
| H2SO4 | ― | Образование CH3COOH– | |||||
Вопросы
- В чем различие дробного и систематического качественного химического анализа?
- Какие реагенты называют групповыми?
- Написать реакции обнаружения ионов Cu2+, Fe3+, Pb2+, Cr3+, Mn2+.
- В чем заключается классификация анионов? Привести примеры реакций.
- Написать реакции обнаружения анионов Cl-, SO42-, NO3.
- Какие ионы можно обнаружить с помощью пламени?
- Привести примеры использования комплексонообразования для открытия ионов. Написать реакции.
- Для обнаружения каких ионов используются окислительно-восстановительные реакции. Написать уравнение реакций.
- В чем заключаются преимущества качественного анализа методом ТСХ (тонкослойной хроматографии)?
- В чем заключается процесс хроматографирования?
- Как производится идентификация веществ в методе ТСХ.
- Что такое Rf, спосою расчета.
- Какие сорбенты используются в методе ТСХ.
- В чем заключается сущность метода качественного хроматографического обнаружения катионов металлов (Co2+, Ni2+, Cu2+, Fe3+ и др.)?
Литература
|
|
|
1. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2006, 460 с.
2. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с.
3. Коренман Я.И., Суханов П.Т. Задачник по аналитической химии. Воронеж: ВГТА, 2004, 339 с.
4. Цитович И.Е. Курс аналитической химии. - М.: Высшая школа, 1994, 495 с.
5. Васильев В.П. Аналитическая химия. - М.: высшая школа, 1989, Т. 1, 384 с.
6. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979,479 с.
7. Крешков А.П. Основы аналитической химии. - М.: Химия, 1970, 471 с.
8. Бончев П.Р. Введение в аналитическую химию. - Л.: Химия, 1978,496 с.
Глава 2.Теоретические основы химического анализа
Закон действующих масс
В современной редакции закон, установленный Гульдбергом и Вааге (1867 г.), можно сформулировать так:
Скорость  реакции
реакции
∑riRi → продукты
(где ri – стехиометрические коэффициенты, Ri – исходные вещества) пропорциональна произведению активностей исходных веществ в некоторых степенях:
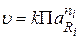 .
.
Данное выражение называется кинетическим уравнением.
k – коэффициент пропорциональности в кинетическом уравнении, называется константойскорости химической реакции;
a – активность, величина, которая будучи подставленной в уравнение для идеальных систем, позволяет рассчитать свойство для реальных систем.
Понятие активности было введено Lewis (1907), как эффективная, действующая, исправленная концентрация с:
 ,
,
где γ – коэффициент активности, который учитывает отклонения в свойствах реальных систем от идеальных, находят экспериментально или в справочнике. В разбавленных растворах при с→0, γ→1, a=c. Для растворов сильных электролитов используют среднеионный коэффициент активности γ±.
|
|
|
В кинетическом уравнении ni – частный порядок реакции по Ri ‑ тому веществу; ni может принимать любые действительные значения; чаще ni ≠ ri,
сумма частных порядков есть порядок реакции ∑ ni = n.
Скорость реакции по i- ому веществу υi есть число молей νi i- ого участника, претерпевающих изменение в единицу времени t в единице реакционного пространства V (объема или площади):
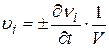 .
.
По определению υi >0, поэтому в формуле стоит + для продуктов реакции и − для исходных веществ. Скорость реакции в целом υ рассчитывают с учетом стехиометрических коэффициентов ri:
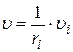 .
.
Если объем постоянный, то скорость реакции υi можно рассчитать как изменение концентрации в единицу времени:
 .
.
На практике имеют дело со средней скоростью 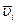 как изменением концентрации за реальное время t:
как изменением концентрации за реальное время t:
 .
.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 273; Нарушение авторских прав?; Мы поможем в написании вашей работы!