
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Альдегіди та кетони
|
|
|
|
Реклама в маркетинговій діяльності.
Реклама — будь-яка платна форма неособистого подання й просування ідей або послуг від імені відомого спонсора (визначення Американської маркетингової асоціації).
В маркетинговій діяльності реклама забезпечує:
· підготовку споживача до сприйняття нового товару або послуги;
· підтримку попиту на високому рівні на стадії масового
· виробництва товару;
· сприяння розширенню ринку збуту.
Принципи створення ефективної реклами:
1. Для того, щоб рекламу помітили, потрібна ідея, і не проста, а гарна, добротна ідея. Не буде цього, і реклама залишиться непоміченою, не спрацює.
2. Текст реклами дуже важливий, але ще важливіше обгрунтування, аргументація.
3. Актуальність - один з головних факторів при виборі аргументації. Гарними аргументами можуть стати якість товару, ціна, швидке постачання, безпечність в експлуатації.
4. У споживача, що тільки познайомився з рекламою, виникає питання: "Скільки це буде коштувати?". Якщо можливо, в рекламі треба вказати вартість товару.
5. Не перебільшувати, не захвалювати товар - споживач завжди скептично налаштований і може відвернутися. Засобами реклами може бути виготовлення фірмової
атрибутики, проспектів і плакатів, фірмових каталогів, брошур та інших друкованих видань, оголошень приватними підприємцями.
1. Альдегіди, будова карбонільної групи
1.1 Фізичні властивості альдегідів.
1.2 Хімичні властивості альдегідів
1.3 Методи одержання альдегідів
2. Кетони
2.1 Ізомерія кетонів.
2.2 Хімічні властивості кетонів
2.3 Методи одержання кетонів
2.4 Окремі представники.
Слово "альдегід" буквально означає "спирт, позбавлений водню" (від лат. al cohol dehyd rogenatus), тобто окислений спирт.
|
|
|
Карбонільні сполуки містять в молекулі карбонільну групу  та діляться на альдегіди и кетони.
та діляться на альдегіди и кетони.
Альдегіди. У молекулах альдегідів карбонільна група сполучена з вуглеводородним радикалом і атомом водню (або двома атомами водню), тобто спільна формула цих сполук:
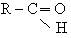
Назви альдегідів по замісній номенклатурі у співвідношенні з правилами іЮПАК виводять з назви відповідного вуглеводню з додаванням суфікса - аль. Перед корнем назви записують бокові замісники з вказівкою їх положення їх числа. Нумерація атомів вуглецю починається з вуглеводного атома карбонільної групы. Приклади:

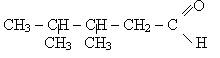
бутаналь 3,4-диметилпентанель
Фізичні властивості: Перший член гомологічного ряду деяких альдегідів НСНО - безбарвний газ, декілька наступних альдегідів - рідини. Вищі альдегіди - тверді речовини. Карбонільна група обслуговує високу реакційну здатність альдегідів. Температура кипіння альдегідів підвищується зі збільшенням молекулярної масы. Кипять вони при більш низькій температурі, ніж відповідні спирти, наприклад пропіоновий альдегід при 48,8 оС, а пропіловый спирт - при 97,8 оС. Густина альдегідів меньша за одиницю. Мурашиний та оцетний альдегіди добре розчинюються у воді, послідуючі - гірше. Нищі альдегіди мають різкий, неприємний запах, деякі вищі - приємний запах.
Хімічні властивості. Присутність карбонільної групи визначає велику реакційну здатність альдегідів. Подвійний звязок між киснем і вуглеводнем в групі С = О на відміну від звичайної, подвійний вуглевод-вуглеводного зв»язку сильно поляризована, так як кисень має значно більшу електронегативність, ніж водень, и електронна густина p-звязку зміщується до кисню:

Окислення альдегідів оксидом срібла в аміачному розчині (реакція "срібного дзеркала"). При нагріванні оксид срібла окислює альдегід і сам відбудовується до чистого срібла:
|
|
|

Відбудоване срібло, покриваючи стінки пробірки тонким слоєм, утворює срібне дзеркало.
Окислення альдегідів гідроксидом міді (II). Свіжозготовлений голубий осад гідроксиду міді (II), окислюючи альдегід, при нагріванні до кирпично-червоного осаду оксиду міді (I):
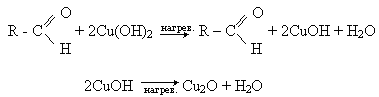
Часто для проведення цієї реакції використовують темно-синю рідину Фелінга - суміш розчинів сульфата міді (II) із лужним розчином сегнетової солі (калієво-натрієва сіль винної кислоти КООН - СНОН - СНОН - СООNa). При нагріванні з альдегідом синій колір реактива зникає і випадає в осад оксид міді (II).
Реакції приєднання. Альдегіди легко приєднують ціановодень HCN і гідросульфіт натрію NaHSO3:

Продукти приєднання NaHSO3 - кристалічні речовини,що розчинюються у воді. При нагріванні з кислотами вони розпадаються з утворенням вихідного альдегіда. Тому остання реакція застосовується для очищення альдегідів.
У присутності нікелевих або платинових каталізаторів альдегіди приєднують водень і відтворюються до первинних спиртів, наприклад:

Приєднуючи спирти, альдегіди утворюють сполуки, які називаються ацетали. Реакція протікає у присутності кислот:

Ацеталі представляють собою прості ефіри двохатомного спирта. Вони легко гідролізуються з утворенням вихідних речовин.
Реакція полімеризації і конденсації. Ці реакції характерні для альдегідів і обумовлені реакційною здатністю карбонільної групи.

Усі молекули альдегіда можуть сполучатися один з одним в присутності лугу з утворенням сполуки з більш довгим водневим ланцюгом, що містить альдегідну і гідроксильну групи:

Таку речовину називають альдолем. При відщепленні молекули води від гідроксибутаналя утворюється альдегід, що містить подвійний звязок в ланцюгу:

Подібні реакції конденсації альдегідів називаються альдольно-кротонової конденсації. При конденсації інших альдегідів реакція також завжди протікає за участю другого вуглеводного атома однієї з молекул, наприклад:

Окислення. При окисленні альдегідів, яке проходить дуже легко, утворююються органічні кислоти або їх солі. Наприклад при окисленні оцтового альдегіда утворюється оцтова кислота:
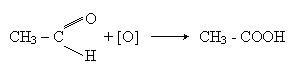
Заміщення кисню карбонільної групи. Атом кисню у молекулі альдегіда може бути заміщений на галоген при дії галогенідів фосфора PCl5 или PBr5, наприклад:
|
|
|
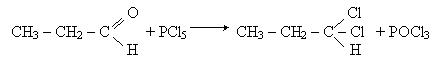
При дії гідроксиламіну NH2OH на альдегіди карбонільний кисень заміщується на оксимідну групу =N - OH:
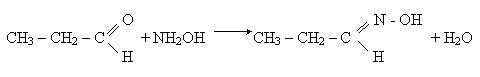
Утворювана нітрогеномістна органічна сполука відноситься до оксимів. Взаємодія з галогенами. Як вже відзначалось, атом водню при другому атомі вуглеглецевого ланцюга альдегідів володіє підвищеною рухливістю. При взаємодії альдегідів з хлором або бромом атом гудрогену легко заміщується на галоген, наприклад:

Отримання.1. Альдегіди виходять при окисленні або каталітичному дегідруванні (відщеплення гідрогену) первинних спиртів:
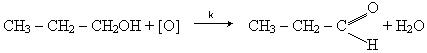
Каталітичне дегідрування спиртів відбувається в присутності металічної міді:

2. Альдегіди утворюються при взаємодії алкенів з оксидом вуглецю (II) і гідрогену (оксосинтез):
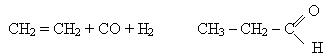
Формальдегід. Першим членом гомологічного ряду насичених альдегідів є формальдегід НСОН. Його називають також метаналь і мурашиний альдегід. Він представляє собою безбарвний газ с характерним різким запахом. Добре розчинюється у воді, образу гідрат СН2О. Н2О. Водний розчин з масовою долею формальдегіда 30-40% називається формаліном. Формалін є хорошим дезінфекційним і консервуючим засобом.
Ацетальдегід. Ацетальдегід (етаналь, оцтовий альдегід) СН3 - СОН представляє собою безбарвну рідину з різким запахом. Добре розчинюється у воді. У великих кількостях виробляється хімічною промисловістю. Основна кількість ацетальдегіда окисляють до оцтової кислоти. Ацетальдегід використовується і для одержання ін. органічних продуктів, у тому числі полімерів.
Кетони. В молекулах кетонів карбонільна група сполучена з двома однаковими або різними вуглегідргенними радикалами

Найпростішим кетоном являєтся ацетон

У відповідності з міжнародною номенклатурою назва кетонів грунтується на назві відповідного водню з доданням суфікса - он. У кінці назви, перед суфіксом, ставиться цифра, що вказує положення в ланцюгу атома водню, з яким звязаний карбонільний кисень. Нумерацію головного ланцюга починають, як завжди, з найбільш розщепленого кінця водневого ланцюга. Якщо розгалуженність однакова, то номерують з того кінця ланцюга, до якого ближче розміщена карбонільна група. Назва кетонів по раціональній номенклатурі, які також використовуються, призводять від назв радикалів, звязаних з карбонільною групою, з додаванням слова "кетон".
|
|
|
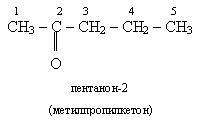

Для деяких кетонів розповсюджені тривіальні назви, наприклад ацетон.
Ізомерія. Ізомерія кетонів обумовлена розгалудженням вуглецевого ланцюга і різним положенням карбонільного оксигену. Розглянемо як зразок ізомери кетона С5Н10О. Для цього кетона можливі два ізомерних кетона, що містять п»ять водневих атомів в головному ланцюгу і один ізомерний кетон з головним ланцюгом з чотирьох атомів водню:
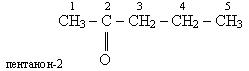


Фізичні властивості. Найпростіші кетони являються безбарвними рідинами, які розчинюються у воді. Кетони мають приємний запах. Вищі кетони - тверді речовини. Газоподібних кетонів не буває, так як вже найпростіший з них (ацетон) рідина. Багато хімічних властивостей, характерні для альдегідів, проявляються і у кетонів.
Хімічні властивості. Для кетонів характерні ті ж реакції заміщення, що і для альдегідів: заміщення карбонільної групы (а) і гідрогенного радикала (b) на галоген:
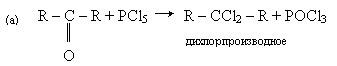
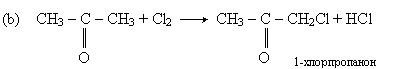
Гідрування кетонів у присутності каталізаторів призводить до утворення вторинних спиртів:

На відміну від альдегідів кетони не взаємодіють зі спиртами, не вступають в реакції конденсації і полімеризації.
Кетони окисляються значно важче ніж альдегіди і тільки сильними окисниками. При окисленні кетонів відбувається розрив (деструкція) вуглецевого ланцюга, і утворюється суміш продуктів. Кетони не вступають у реакцію срібного дзеркала.
Заміщення кисню карбонільної групи. Так само, як і в альдегідах, атом кисню в молекулі кетона може бути заміщений дією галогенідів фосфора (PCl5, PBr5) або гідроксиламіну NH2OH
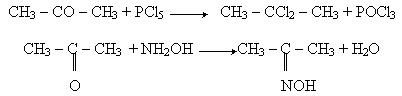
У першій реакції утворюється дигалогенпохідний алкана, в другій - оксим.
Взаємодія з галогенами. Як і альдегіди, кетони легко реагують з хлором і бромом:
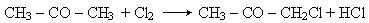
Одержання. 1. Кетони утворюються при окисленні або каталітичному дегідрурованні вторинних спиртів, наприклад:
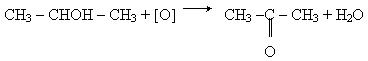

2. Як і альдегіди, кетони можна отримати гідролізом дигалогенпохідних алканів. Щоб отримати кетон, обидва атома галогену у вихідному сполученні повинні знаходитися при одному (не крайньому) атомі карбону:

3. Кетони утворюються у результаті приєднання води до гомологів ацетилена в присутності каталізаторів - солей ртуті (II), наприклад:

Ацетон. Ацетон (пропанон, диметилкетон) представляє собою безбарвну рідину з характерним запахом. Температура кипіння ацетона 56,2 оС. Добре розчинний у воді, і сам являється розчинником органічних сполук.
Ацетон - важливий продукт хімічної промисловості. Його отримують разом з фенолом кумольним методом.
Другий промисловий спосіб полягає в гідратації пропилена з отриманням спирту та подальшим його каталітичним дегідрурованням або окисленням:
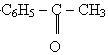

Ацетон застосовується як розчинник. Він також являється вихідною речовиною для синтезу багатьох органічних сполук. Ацетофенон (метилфенилкетон) -
- безбарвна речовина з температурою кипіння 19,6 оС. В воді практично нерозчинний. Має запах черемхи. Застосовується при виготовленні парфумерних товарів.
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 8395; Нарушение авторских прав?; Мы поможем в написании вашей работы!