
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения состава растворов
|
|
|
|
РАСТВОРИМОСТЬ
Раствор – однофазная гомогенная система, состоящая из двух или более компонентов, а также продуктов их взаимодействия, состав которой может непрерывно меняться в пределах, ограниченных взаимной растворимостью веществ.
Вещество называют растворителем, если при образовании раствора оно не меняет своего агрегатного состояния, остальные компоненты раствора считают растворенными веществами. В случае, когда все компоненты при образовании раствора остаются в том же агрегатном состоянии, растворителем является компонент, которого в системе больше.
Растворимостью называют, как способность вещества образовывать раствор с данным растворителем, так и количественную характеристику этой способности. Качественно растворимость характеризуется понятиями «хорошо растворимо», «мало растворимо», «нерастворимо». Количествен-ной мерой растворимости является масса вещества в граммах, которая способна раствориться в 100 г растворителя при данной температуре с образованием насыщенного раствора.
Раствор называется насыщенным, если в нем находится предельное при данных условиях количество растворенного вещества. Если в растворе содержится больше растворенного вещества, чем это определяется растворимостью, раствор называется пересыщенным, а если меньше – ненасыщенным.
Важнейшей характеристикой раствора является количественное содержание растворенных веществ. На практике состав раствора принято выражать с помощью следующих величин:
1. Массовая доля растворенного вещества w2 (иначе процентная массовая концентрация) – отношение массы растворенного вещества m 2 к массе раствора m
 (1)
(1)
Здесь и далее у величин, относящихся к растворителю, применяется индекс «1», индекс «2» относится к растворенному веществу, а отсутствие индекса указывает на свойство раствора как целого.
|
|
|
Это безразмерная величина, выраженная в долях единицы или в процентах, % масс. Таким образом, w2 показывает, сколько грамм растворенного вещества содержится в ста массовых частях раствора.
2. Моляльная концентрация вещества Сm (иначе моляльность раствора) – отношение числа моль растворенного вещества n 2 к массе растворителя m 1 в килограммах
 , (2)
, (2)
где М 2 – молярная масса растворенного вещества, г/моль.
Если массу растворителя выражать в граммах, то для расчета моляльности следует пользоваться формулой
 . (3)
. (3)
Данный способ выражения состава раствора показывает, сколько моль растворенного вещества содержится в 1 кг растворителя. Его единицы измерения – моль/кг.
3. Молярная концентрация вещества С 2 (иначе молярность раствора) – отношение числа моль растворенного вещества к объёму раствора V в дм3 (иначе в литрах)
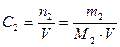 . (4)
. (4)
Она показывает, сколько моль растворенного вещества содержится в 1 дм3 раствора. Единицы измерения – моль/дм3 или М.
4. Молярная концентрация эквивалента вещества С 2  (иначе нормальность раствора, нормальная концентрация или эквивалентная концентрация) – отношение числа моль эквивалентов растворенного вещества n 2
(иначе нормальность раствора, нормальная концентрация или эквивалентная концентрация) – отношение числа моль эквивалентов растворенного вещества n 2  к объёму раствора в дм3
к объёму раствора в дм3
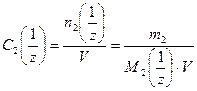 , (5)
, (5)
где М 2  – молярная масса эквивалента растворенного вещества, г/моль; z – число эквивалентности растворенного вещества.
– молярная масса эквивалента растворенного вещества, г/моль; z – число эквивалентности растворенного вещества.
Нормальность раствора показывает, сколько моль эквивалентов растворенного вещества содержится в 1 дм3 раствора. Единицы измерения –моль/дм3 или н.
Взаимосвязь между молярной и нормальной концентрациями одного и того же растворенного вещества выражается соотношением
 . (6)
. (6)
То есть, эквивалентная концентрация в z раз больше молярной концентрации.
5. Титр раствора Т – масса растворенного вещества в граммах, которая содержится в одном см3 (иначе 1 мл) раствора
|
|
|
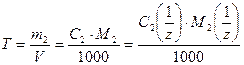 . (7)
. (7)
Единицы измерения данного способа выражения состава раствора –г/мл или г/см3.
6. Мольная доля растворенного вещества х 2 – отношение числа моль растворенного вещества к общему числу моль всех компонентов раствора n
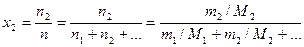 . (8)
. (8)
Это безразмерная величина, выраженная в долях единицы.
Общее правило, используемое для приготовления разбавленных растворов из концентрированных: при одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу:
w1 × m 1 = w2 × m 2, (9)
где m 1(m 2) – масса исходного (конечного) раствора. Если массу раствора представить через его плотность и объем, то формула (9) примет вид
ω1 · ρ1 · V 1= ω2 · ρ2 · V 2, (10)
где V 1(V 2) – объем исходного (конечного) раствора; r1 (r2) – плотность исходного (конечного) раствора.
Если раствор получают путем смешивания двух растворов с различной концентрацией одного и того же растворенного вещества, то содержание растворенного вещества в конечном растворе можно определить с помощью правила смешивания: массы смешиваемых растворов m 1 и m 2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3
m 1 / m 2 = (w3 – w2) / (w1 – w3). (11)
При использовании правила смешивания применяют так называемое правило креста (иначе квадрат Пирсона):
w1w3 – w2 m 1
w3
w2w1 – w3 m 2
m 1 / m 2 = (w3 – w2) / (w1 – w3)
Пояснение: по диагонали из большей концентрации вычитают меньшую, получают (w1 – w3), так какw1 >  w3, и (w3 – w2), так какw3 >
w3, и (w3 – w2), так какw3 >  w2. Затем составляют отношение масс исходных растворов m 1 / m 2.
w2. Затем составляют отношение масс исходных растворов m 1 / m 2.
Если при сливании двух растворов, содержащих различные по природе растворенные вещества, между ними происходит химическое взаимодействие, то по закону эквивалентов вещества реагируют в количествах, пропорциональных их эквивалентам. Например, для процесса взаимодействия кислоты с основанием будет выполняться соотношение
 . (12)
. (12)
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 2170; Нарушение авторских прав?; Мы поможем в написании вашей работы!