
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В. Аллостерическая регуляция аэробного распада глюкозы и глюкогенеза в печени энергетическим статусом клетки 1 страница
|
|
|
|
Аллостерическая регуляция скорости гликолиза, зависимая от изменения соотношения АТФ/АДФ, направлена на изменение скорости использования глюкозы непосредственно клетками печени. Глюкоза в клетках печени используется не только для синтеза гликогена и жиров, но также и как источник энергии для синтеза АТФ. Основными потребителями АТФ в гепатоцитах
являются процессы трансмембранного переноса веществ, синтез белков, гликогена, жиров, глюконеогенез. От скорости утилизации АТФ в этих процессах зависит скорость его синтеза. АТФ, АДФ и АМФ, а также NAD+ и NADH служат аллостерическими эффекторами некоторых гликолитических ферментов и ферментов глюконеогенеза. В частности, АМФ активирует фосфофруктокиназу и ингибирует фруктозо-1,6-бисфосфатазу. АТФ и NADH ингибируют пируваткиназу, а АДФ активирует пируваткарбоксилазу.
Следовательно, при усилении расходования АТФ и снижении его концентрации с одновременным увеличением концентрации АМФ, активируется гликолиз и образование АТФ, а глюконеогенез при этом замедляется. Кроме того, от соотношения АТФ/АДФ, АМФ и NAD/ NADH зависит скорость реакций общего пути катаболизма (см. раздел 6).
350:: 351:: 352:: 353:: 354:: 355:: Содержание
355:: 356:: 357:: 358:: Содержание
XI. РЕГУЛЯЦИЯ СОДЕРЖАНИЯ ГЛЮКОЗЫ В КРОВИ
Результат регуляции метаболических путей превращения глюкозы - постоянство концентрации глюкозы в крови.
Концентрация глюкозы в артериальной крови в течение суток поддерживается на постоянном уровне 60-100 мг/дл (3,3-5,5 ммоль/л). После приёма углеводной пищи уровень глюкозы возрастает в течение примерно 1 ч до 150 мг/дл
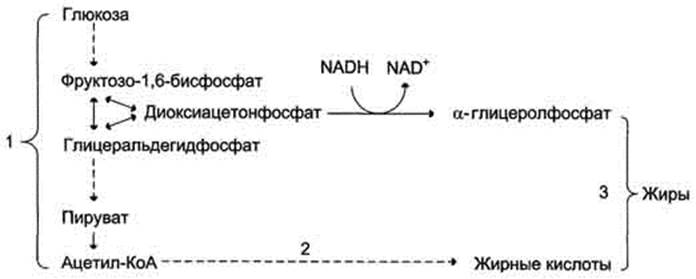
Рис. 7-58. Синтез жира из углеводов. 1 - окисление глюкозы до пирувата и окислительное декарбоксилирование пирувата приводят к образованию ацетил-КоА; 2 - ацетил-КоА является строительным блоком для синтеза жирных кислот; 3 - жирные кислоты и а-глицеролфосфат, образующийся в реакции восстановления дигидроксиацетонфосфата, участвуют в синтезе триа-цилглицеролов.
|
|
|
(∼8 ммоль/л, алиментарная гипергликемия), а затем возвращается к нормальному уровню (примерно через 2 ч). На рисунке 7-59 представлен график изменений концентрации глюкозы в крови в течение суток при трёхразовом приёме пищи.
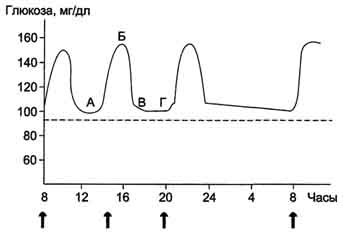
Рис. 7-59. Изменение концентрации глюкозы в крови в течение суток. А, Б - период пищеварения; В, Г - постабсорбтивный период. Стрелкой указано время приёма пищи, пунктиром показана нормальная концентрация глюкозы.
А. Регуляция содержания глюкозы в крови в абсорбтивном и постабсорбтивном периодах
Для предотвращения чрезмерного повышения концентрации глюкозы в крови при пищеварении основное значение имеет потребление глюкозы печенью и мышцами, в меньшей мере - жировой тканью. Следует напомнить, что более половины всей глюкозы (60%), поступающей из кишечника в воротную вену, поглощается печенью. Около 2/3 этого количества откладывается в печени в форме гликогена, остальная часть превращается в жиры и окисляется, обеспечивая синтез АТФ. Ускорение этих процессов инициируется повышением инсулинглюкагонового индекса. Другая часть глюкозы, поступающей из кишечника, попадает в общий кровоток. Примерно 2/3 этого количества поглощается мышцами и жировой тканью. Это обусловлено увеличением проницаемости мембран мышечных и жировых клеток для глюкозы под влиянием высокой концентрации инсулина. Глюкоза в мышцах откладывается в форме гликогена, а в жировых клетках превращается в жиры. Остальная часть глюкозы общего кровотока поглощается другими клетками (инсулинонезависимыми).
При нормальном ритме питания и сбалансированном рационе концентрация глюкозы в крови и снабжение глюкозой всех органов поддерживается главным образом за счёт синтеза и распада гликогена. Лишь к концу ночного сна, т.е. к концу самого большого перерыва между приёмами пищи, может несколько увеличиться роль глюконеогенеза, значение которого будет возрастать, если завтрак не состоится и голодание продолжится (рис. 7-60).
|
|
|

Рис. 7-60. Источники глюкозы в крови в период пищеварения и во время голодания. 1 - в период пищеварения углеводы пищи являются основным источником глюкозы в крови; 2 - в постабсорбтивный период печень поставляет глюкозу в кровь за счёт процессов гликогенолиза и глюконеогенеза, причём в течение 8-12 ч уровень глюкозы в крови поддерживается в основном за счёт распада гликогена; 3 - глюконеогенез и гликоген в печени участвуют в равной степени в поддержании нормальной концентрации глюкозы; 4 - в течение суток гликоген печени практически полностью исчерпывается, и скорость глюконеогенеза увеличивается; 5 - при длительном голодании (1 нед и более) скорость глюконеогенеза уменьшается, но глюконеогенез остаётся единственным источником глюкозы в крови.
Б. Регуляция содержания глюкозы в крови при предельном голодании
При голодании в течение первых суток исчерпываются запасы гликогена в организме, и в дальнейшем источником глюкозы служит
только глюконеогенез (из лактата, глицерина и аминокислот). Глюконеогенез при этом ускоряется, а гликолиз замедляется вследствие низкой концентрации инсулина и высокой концентрации глюкагона (механизм этого явления описан ранее). Но, кроме того, через 1-2 сут существенно проявляется действие и другого механизма регуляции - индукции и репрессии синтеза некоторых ферментов: снижается количество гликолитических ферментов и, наоборот, повышается количество ферментов глюконеогенеза. Изменение синтеза ферментов также связано с влиянием инсулина и глюкагона (механизм действия рассматривается в разделе 11).
Начиная со второго дня голодания достигается максимальная скорость глюконеогенеза из аминокислот и глицерина. Скорость глюконеогенеза из лактата остаётся постоянной. В результате синтезируется около 100 г глюкозы ежесуточно, главным образом в печени.
Следует отметить, что при голодании глюкоза не используется мышечными и жировыми клетками, поскольку в отсутствие инсулина не проникает в них и таким образом сберегается для снабжения мозга и других глюкозозависимых клеток. Поскольку при других условиях мышцы - один из основных потребителей глюкозы, то прекращение потребления глюкозы мышцами при голодании имеет существенное значение для обеспечения глюкозой мозга. При достаточно продолжительном голодании (несколько дней и больше) мозг начинает использовать и другие источники энергии (см. раздел 8).
|
|
|
Вариантом голодания является несбалансированное питание, в частности такое, когда по калорийности рацион содержит мало углеводов - углеводное голодание. В этом случае также активируется глюконеогенез, и для синтеза глюкозы используются аминокислоты и глицерол, образующиеся из пищевых белков и жиров.
В. Регуляция содержания глюкозы в крови в период покоя и во время физической нагрузки
Как в период покоя, так и во время продолжительной физической работы сначала источником глюкозы для мышц служит гликоген, запасённый в самих мышцах, а затем глюкоза крови. Известно, что 100 г гликогена расходуется на бег примерно в течение 15 мин, а запасы гликогена в мышцах после приёма углеводной пищи могут составлять 200-300 г. На рисунке 7-61 представлены значения гликогена печени и глюконеогенеза для обеспечения глюкозой работы мышц разной интенсивности и продолжительности. Регуляция мобилизации гликогена в мышцах и печени, а также глюконеогенеза в печени описана ранее (главы VII, X).
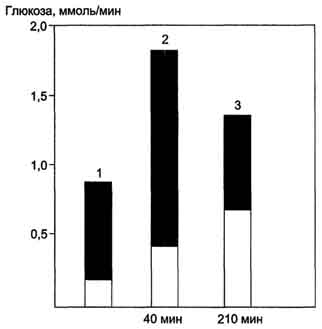
Рис. 7-61. Вклад гликогена печени и глюконеогенеза в поддержание уровня глюкозы крови в период покоя и во время продолжительных физических упражнений. Тёмная часть столбика-вклад гликогена печени в поддержание уровня глюкозы в крови; светлая - вклад глюконеогенеза. При увеличении продолжительности физической нагрузки с 40 мин (2) до 210 мин (3) распад гликогена и глюконеогенез практически в равной степени обеспечивают кровь глюкозой. 1 - состояние покоя (постабсорбтивный период); 2,3 - физическая нагрузка.
|
|
|
Итак, изложенные сведения позволяют сделать вывод о том, что координация скоростей гликолиза, глюконеогенеза, синтеза и распада гликогена с участием гормонов обеспечивает:
- предотвращение чрезмерного повышения концентрации глюкозы в крови после приёма пищи;
- запасание гликогена и его использование в промежутках между приёмами пищи;
- снабжение глюкозой мышц, потребность которых в энергии быстро возрастает при мышечной работе;
- снабжение глюкозой клеток, которые при голодании в качестве источника энергии используют преимущественно глюкозу (нервные клетки, эритроциты, мозговое вещество почек, семенники).
355:: 356:: 357:: 358:: Содержание
358:: 359:: 360:: 361:: 362:: 363:: 364:: Содержание
XII. ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ПРЕВРАЩЕНИЯ ГЛЮКОЗЫ
Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) - окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстановленный NADPH.
В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным ко-ферментом NADPH, который используется в восстановительных процессах.
Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно Пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
А. Окислительный этап
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования.
Первая реакция дегидрирования - превращение глюкозо-6-фосфата в глюконолактон-6-фосфат - катализируется МАDР+-зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NADPH.
Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы.
Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NADPH (рис. 7-62).
Восстановленный NADPH ингибирует первый фермент окислительного этапа пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназу. Превращение NADPH в окисленное состояние NADP+ приводит к ослаблению ингибирования фермента. При этом скорость соответствующей реакции возрастает, и образуется большее количество NADPH.
Суммарное уравнение окислительного этапа пентозофосфатного пути можно представить в виде:
Глюкозо-6-фосфат + 2 NADP+ + Н2О → Рибулозо-5-фосфат + 2 NADPH + Н+ + СО2.
Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода. NADPH как донор водорода участвует в анаболических процессах, например в синтезе холестерина. Это источник восстановительных эквивалентов для цитохрома Р450, катализирующего образование гидроксильных групп при синтезе стероидных гормонов, жёлчных кислот, при катаболизме лекарственных веществ и других чужеродных соединений (см. разделы 8, 11, 12). Высокая активность фермента глюкозо-6-фосфатдегидрогеназы обнаружена в фагоцитирующих лейкоцитах, где NADPH-оксидаза использует восстановленный NADPH для образования супероксидного иона из молекулярного кислорода. Супероксидный ион генерирует другие активные формы кислорода, под действием которых и
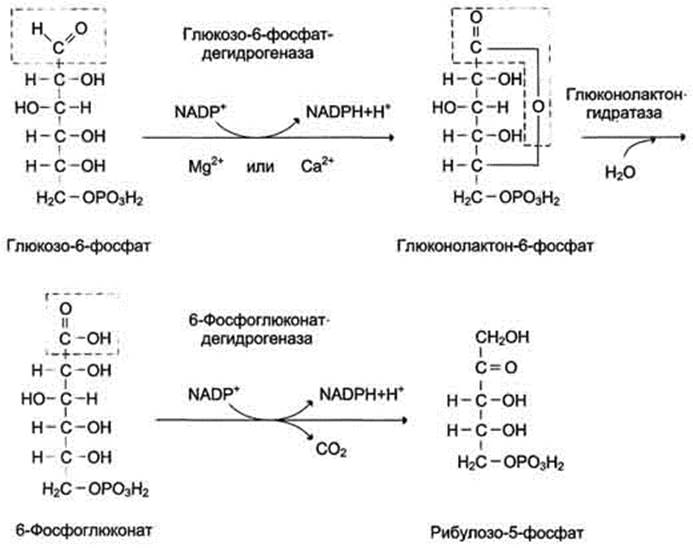
Рис. 7-62. Окислительный этап пентозофосфатного пути.
повреждаются молекулы ДНК, белков, липидов бактериальньж клеток. Синтез жирных кислот из углеводов в печени является основным путём утилизации NADPH и обеспечивает регенерацию окисленной формы NADP+. В печени глюкозо-6-фосфатдегидрогеназа, как и ключевые ферменты гликолиза и биосинтеза жирных кислот, индуцируется при увеличении соотношения инсулин/глюкагон после приёма богатой углеводами пищи.
Несмотря на то, что NADPH образуется также при окислении малата до пирувата и диоксида углерода (при участии НАDР+-зависимой малатдегидрогеназы) и дегидрировании изо-цитрата (при участии НАВР+-зависимой изоцитратдегидрогеназы), в большинстве случаев потребности клеток в восстановительных эквивалентах удовлетворяются за счёт пентозофосфатного пути.
Реакции окислительного пути протекают только в том случае, если восстановленный ко-фермент NADPH возвращается в исходное окисленное состояние NADP+ при участии NADPH-зависимых дегидрогеназ (т.е. при условии использования гидрированного NADPH в восстановительных процессах). Если потребности клетки в NADPH незначительны, рибо-зо-5-фосфат образуется в результате обратимых реакций неокислительного этапа пентозофосфатного пути, используя в качестве исходных веществ метаболиты гликолиза - глицеральдегид-3-фосфат и фруктозо-6-фосфат.
Б. Неокислительный этап
Неокислительный этап пентозофосфатного пути включает серию обратимых реакций, в результате которых рибулозо-5-фосфат превращается в рибозо-5-фосфат и ксилулозо-5-фосфат, и далее за счёт переноса углеродных фрагментов в метаболиты гликолиза - фруктозо-6-фосфат и глицеральдегид-3-фосфат. В этих превращениях принимают участие ферменты: эпимераза, изомераза, транскетолаза и трансальдолаза. Транскетолаза в качестве кофермента использует тиаминдифосфат. Неокислительный этап пентозофосфатного пути не включает реакции дегидрирования
и поэтому используется только для синтеза пентоз.
Рибулозо-5-фосфат служит субстратом для двух ферментов. Фермент рибулозо-5-фосфат-З-эпимераза изменяет стехиометрическое положение одной ОН-группы у третьего атома углерода, превращая рибулозо-5-фосфат в ксилулозо-5-фосфат. Другой фермент - рибулозо-5-фосфатизомераза - катализирует превращение рибулозо-5-фосфата в рибозо-5-фосфат (рис. 7-63). Рибозо-5-фосфат, образующийся в неокислительной фазе, обеспечивает клетки рибозой, необходимой для синтеза нуклеотидов, которые служат предшественниками и структурными компонентами ко-ферментов дегидрогеназ и нуклеиновых кислот.
Ферменты транскетолаза и трансальдолаза катализируют перенос двух- и трёхуглеродных фрагментов, соответственно используя в качестве донора углеродных фрагментов кетозу, а альдозу - в качестве акцептора. Эти реакции протекают в 2 этапа: сначала происходит отщепление углеродного фрагмента от молекулы-донора, -а затем - перенос этого фрагмента на молекулу, выполняющую роль акцептора. Транскетолаза в неокислительной фазе пентозофосфатного пути катализирует 2 реакции. В первой реакции (рис. 7-64) транскетолаза расщепляет связь С-С между кетогруппой и соседним атомом углерода в молекуле ксилулозо-5-фосфат, в результате чего кетосахар превращается в альдозу, глицеральдегид-3-фосфат, содержащую на 2 атома углерода меньше. Образующийся после расщепления двухуглеродный фрагмент остаётся ковалентно связанным в каталитическом центре фермента с ко-ферментом тиаминдифосфатом. Далее фермент переносит двухуглеродный фрагмент на альдегидную группу альдосахара, образую новую кетозу - седргептулозо-7-фосфат.
Трансальдолаза переносит трёхуглеродный фрагмент от седогептулозо-7-фосфата на глицеральдегид-3-фосфат, образуя эритрозо-4-фосфат и фруктозо-6-фосфат (рис. 7-65).
Эта реакция подобна реакции альдольного расщепления гликолитического пути, за исключением того, что в данном случае трёхуглеродный фрагмент, содержащий кетогруппу, переносится на альдосахар глицеральдегид-3-фосфат, а в гликолитическом пути кетофрагмент высвобождается в виде дигидроксиацетонфосфата.
В следующей реакции, катализируемой транс-кетолазой, происходит перенос двухуглеродного фрагмента от ксилулозо-5-фосфата на эритрозо-4-фосфат. Продуктами этой реакции являются фруктозо-6-фосфат и глицеральдегид-3-фосфат (рис. 7-66).
Так как все реакции неокислительного этапа обратимы, образование рибозо-5-фосфата может происходить не только в результате изомерного превращения продукта окислительной фазы пентозофосфатного пути рибулозо-5-фосфата в рибозо-5-фосфат под действием изомеразы, но также и из промежуточных продуктов гликолиза - фруктозо-6-фосфата и глицеральдегид-3-фосфата. Последовательность превращений, приводящих к образованию рибозо-5-фосфата из таких продуктов гликолитического пути, можно представить в виде:
2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат → 2 Ксилулозо-5-фосфат + Рибозо-5-фосфат 2 Ксилулозо-5-фосфат → 2 Рибулозо-5-фосфат 2 Рибулозо-5-фосфат → 2 Рибозо-5-фосфат.
Суммарный результат метаболизма 3 молекул рибулозо-5-фосфата в неокислительной фазе пентозофосфатного пути - образование 2 молекул фруктозо-6-фосфата и 1 молекулы глицеральдегид-3-фосфата. Далее фруктозо-6-фосфат и глицеральдегид-3-фосфат могут превратиться в глюкозу. С учётом стехиометрического коэффициента, равного 2, для образования 5 молекул глюкозы (содержащих 30 атомов углерода) потребуются 4 молекулы фруктозо-6-фосфата и 2 молекулы глицеральдегид-3-фосфата (в сумме содержащие также 30 атомов углерода) или, соответственно, 6 молекул рибулозо-5-фосфата. Таким образом, неокислительный путь можно представить как процесс возвращения пентоз в фонд гексоз.
В. Пентозофосфатный цикл
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс.
Такой процесс можно описать общим уравнением:
6 Глюкозо-6-фосфат + 12 NADP+ + 2 Н2О → 5 Глюкозо-6-фосфат + 12 NADPH +12 Н+ + 6 СO2.
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СО2. Ферменты неокислительной
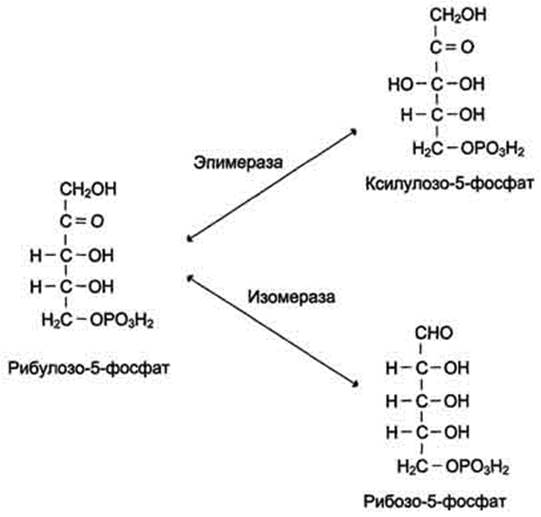
Рис. 7-63. Превращения рибулозо-5-фосфата.
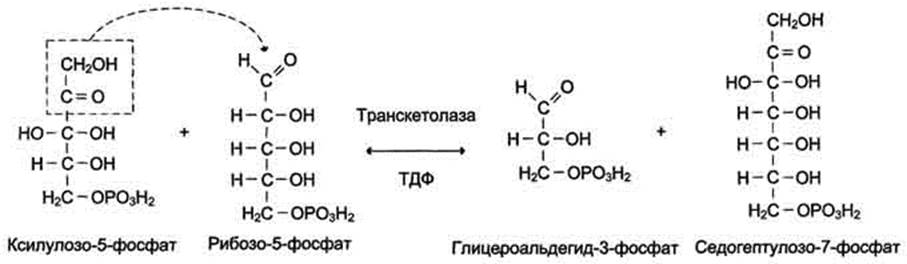
Рис. 7-64. Реакция переноса двухуглеродного фрагмента, катализируемая транскетолазои.
фазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NADPH, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс назьюают пентозофосфатным циклом (рис. 7-67).
Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, необходимый для синтеза жиров, не накапливая пентозы.
Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода - NADPH. Гидрированный NADPH служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например

Рис. 7-65. Реакция, катализируемая трансальдолазой.
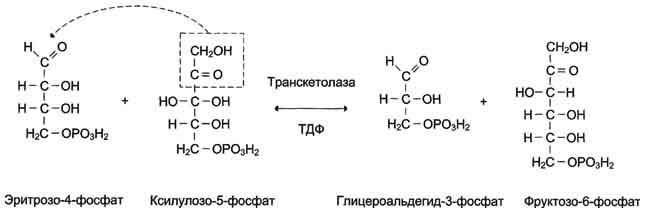
Рис. 7-66. Реакция, катализируемая транскетолазой.
жирных кислотах, высвобождается при их катаболизме и используется клетками.
Г. Дефект глюкозо-6-фосфат дегидрогеназы в эритроцитах
Неферментативное окисление гемоглобина (Fe2+) в метгемоглобин (Fe3+) приводит к одноэлектронному восстановлению кислорода и появлению реакционно-способного анион-радикала - супероксида 02-, который служит предшественником других активных форм кислорода: пероксида водорода Н2О2 и гидроксильного радикала ОН-. Активные формы кислорода являются сильнейшими окислителями и поэтому способны вызывать серьёзные повреждения молекул ДНК, белков, ненасыщенных липидов.
В эритроцитах, как и в большинстве клеток, присутствует тиолсодержащий трипептид - глу-татион (γ-глутамил-цистенил-глицин). Восстановленная форма глутатиона (Г-SH) содержит SH-группу (рис. 7-68), которая может служить донором электронов в реакциях восстановления. Под действием фермента глутатионпероксидазы восстановленный глутатион превращает молекулу пероксида водорода в молекулу воды, а сам переходит в окисленное состояние (Г-88-Г). Регенерацию восстановленного глутатиона обеспечивает глутатионредуктаза, используя в качестве донора водорода гидрированный NADPH. Для эритроцитов единственным источником получения NADPH служит пентозофосфатный путь, для других тканей существует альтернативный способ - при участии NADH-зависимой малатде-гидрогеназы (малик-фермент).

Рис. 7-67. Пентозофосфатный цикл в жировой ткани.
Взаимодействие восстановленного глутатиона с пероксидом водорода в эритроцитах предохраняет цистеиновые остатки в протомерах гемоглобина от окисления. При генетическом дефекте глюкозо-6-фосфатдегидрогеназы концентрация восстановленного кофермента NADPH уменьшается, в результате чего резко снижается концентрация восстановленного глутатиона, а в клетке, соответственно, увеличивается количество активных форм кислорода. В этом случае окисление SH-групп молекул гемоглобина в эритроцитах приводит к образованию перекрёстных дисульфидных связей и агрегации протомеров гемоглобина с формированием телец Хайнца (см. раздел 14). В присутствии телец Хайнца пластичность мембраны нарушается, и она теряет способность к деформации при прохождении эритроцитов через капилляры. Это вызывает нарушение целостности мембраны, что приводит к гемолизу эритроцитов. Некоторые лекарственные вещества, например антималярийный препарат примахин, сульфаниламиды, также снижают способность
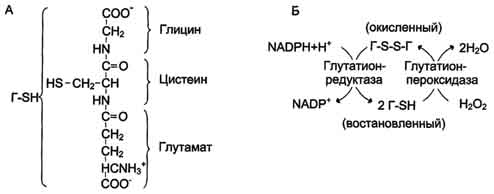
Рис. 7-68. Восстановление глутатиона под действием глутатионредуктазы. А - строение глутатиона; Б - восстановление глутатиона.
эритроцитов бороться с активными формами кислорода.
358:: 359:: 360:: 361:: 362:: 363:: 364:: Содержание
364:: 365:: 366:: 367:: 368:: 369:: Содержание
XIII. МЕТАБОЛИЗМ ФРУКТОЗЫ И ГАЛАКТОЗЫ
Метаболизм фруктозы и галактозы включает пути использования их для синтеза других веществ (гетерополисахаридов, лактозы и др.) и участие в энергообеспечении организма. В последнем случае фруктоза и галактоза превращаются в печени либо в глюкозу, либо в промежуточные продукты её метаболизма. Таким образом, в результате фруктоза и галактоза наряду с глюкозой могут быть окислены до СО2 и Н2О или использованы на синтез гликогена и триацилглицеролов.
Причиной нарушения метаболизма фруктозы и галактозы может быть дефект ферментов, катализирующих промежуточные реакции их обмена. Эти нарушения встречаются относительно редко, но могут представлять достаточно серьёзную опасность, так как накапливаемые промежуточные метаболиты фруктозы и галактозы обладают токсичностью.
А. Метаболизм фруктозы
Значительное количество фруктозы, образующееся при расщеплении сахарозы, прежде чем поступить в систему воротной вены, превращается в глюкозу уже в клетках кишечника. Другая часть фруктозы всасывается с помощью белка-переносчика, т.е. путём облегчённой диффузии.
Метаболизм фруктозы (рис. 7-69) начинается с реакции фосфорилирования (реакция 1), катализируемой фруктокиназой с образованием фруктозо-1-фосфата. Фермент обнаружен в печени, а также в почках и кишечнике. Этот фермент обладает абсолютной специфичностью, поэтому, в отличие от глкжокиназы, инсулин не влияет на его активность. Последнее обстоятельство объясняет, почему уровень выведения фруктозы в моче у больных сахарным диабетом и здоровых не отличается. Фруктозе-1-фосфат не может превращаться во фруктозо-6-фосфат из-за отсутствия соответствующего фермента. Вместо этого фруктозо-1-фосфат далее расщепляется фруктозо-1-фосфатальдолазой (альдолаза В) на глицеральдегид и дигидроксиацетон-3-фосфат (реакция 2). Последний является промежуточным продуктом гликолиза и образуется в ходе реакции, катализируемой фруктозо-1,6-бисфосфосфатальдолазой (альдолаза А). Глицеральдегид может включаться в гликолиз после его фосфорилирования с участием АТФ (реакция 3). Две молекулы триозофосфатов либо распадаются по гликолитическому пути, либо конденсируются с образованием фруктозо-1,6-бисфосфата и далее участвуют в глюконеогенезе (реакции 8, 7, 5, 9). Фруктоза в печени включается главным образом во второй путь. Часть дигидроксиацетон-3-фосфата может восстанавливаться до глицерол-3-фосфата и участвовать в синтезе триацилглицеролов.
Следует отметить, что включение фруктозы в метаболизм через фруктозо-1-фосфат минует стадию, катализируемую фосфофруктокиназой (реакция 6), которая является пунктом метаболитического
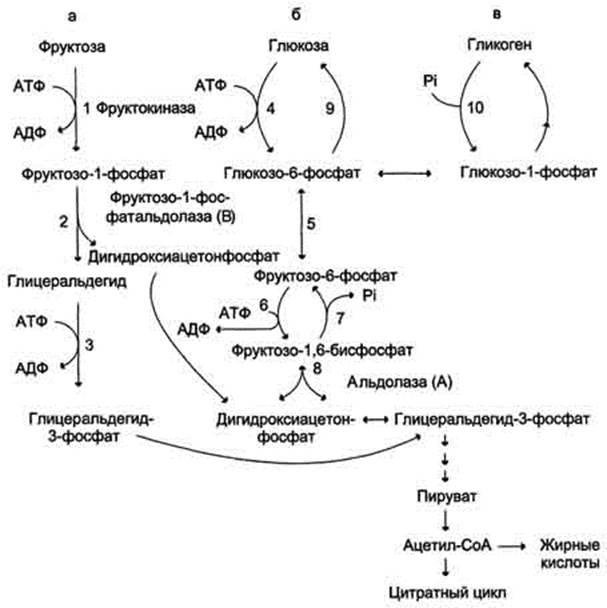
Рис. 7-69. Метаболизм фруктозы. а - превращение фруктозы в дигидроксиацетон-3-фосфат и глицеральдегид-3-фосфат; б - путь включения фруктозы в гликолиз и глюконеогенез; в - путь включения фруктозы в синтез гликогена.
контроля скорости катаболизма глюкозы. Этим обстоятельством можно объяснить, почему увеличение количества фруктозы ускоряет в печени процессы, ведущие к синтезу жирных кислот, а также их этерификацию с образованием триацилглицеролов.
Б. Нарушения метаболизма фруктозы
Нарушения метаболизма фруктозы, причиной которых является дефект ферментов, отражены в табл. 7-5.
Недостаточность фруктокиназы клинически не проявляется. Фруктоза накапливается в крови и выделяется с мочой, где её можно обнаружить лабораторными методами. Очень важно не перепутать эту безвредную аномалию с сахарным диабетом. Данное заболевание известно как доброкачественная эссенциальная фруктозурия и встречается с частотой 1:130 000.
Наследственная непереносимость фруктозы, возникающая при генетически обусловленном дефекте фруктозо-1-фосфатальдолазы, не проявляется, пока ребёнок питается грудным молоком, т.е. пока пища не содержит фруктозы. Симптомы возникают, когда в рацион добавляют фрукты, соки, сахарозу. Рвота, боли в животе, диарея, гипогликемия и даже кома и судороги возникают через 30 мин после приёма пищи, содержащей фруктозу. У маленьких детей и подростков, продолжающих принимать фруктозу, развиваются хронические нарушения функций печени и почек. Непереносимость фруктозы - достаточно частая аутосомно-рецессивная форма патологии.
Дефект альдолазы фруктозе-1-фосфата сопровождается накоплением фруктозе-1-фосфата, который ингибирует активность фосфоглюко-мутазы, превращающей глюкозо-1-фосфат в глюкозо-6-фосфат и обеспечивающей включение продукта гликогенфосфорилазной реакции
Таблица 7-5. Нарушения метаболизма фруктозы
| Неактивный фермент | Блокируемая реакция | Локализация фермента | Клинические проявления и лабораторные данные |
| Фруктокиназа | Фруктоза + АТФ → Фруктозе-1-фосфат + АДФ | Печень Почки Энтероциты | Фруктоземия, фруктозурия |
| Фруктозе-1-фосфатальдолаза | Фруктозе-1-фосфат → Дигидроксиацетон-3 -фосфат + Глицеральдегид | Печень | Рвота, боли в животе, диарея, гипогликемия, Гипофосфатемия, фруктоземия, гиперурикемия, хроническая недостаточность функций печени, почек. |
в метаболизм. Поэтому происходит торможение распада гликогена на стадии образования глюкозо-1 -фосфата, в результате чего развивается гипогликемия. Как следствие, ускоряется мобилизация липидов и окисление жирных кислот. Следствием ускорения окисления жирных кислот и синтеза кетоновых тел, замещающих энергетическую функцию глюкозы, может быть метаболический ацидоз (см. раздел 8), так как кетоновые тела являются кислотами и при высоких концентрациях снижают рН крови.
Результатом торможения гликогенолиза и гликолиза является снижение синтеза АТФ. Кроме того, накопление фосфорилированной фруктозы ведёт к нарушению обмена неорганического фосфата и гипофосфатемии.
Для пополнения внутриклеточного фосфата ускоряется распад адениловых нуклеотидов. Продукты распада этих нуклеотидов включаются в катаболизм, проходя стадии образования гипоксантина, ксантина и, наконец, мочевой кислоты. Повышение количества мочевой кислоты и снижение экскреции уратов в условиях метаболического ацидоза проявляются в виде гипер-урикемии. Следствием гиперурикемии может быть подагра даже в молодом возрасте (см. раздел 10).
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 3508; Нарушение авторских прав?; Мы поможем в написании вашей работы!