
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Трансамінування(переамінування)
|
|
|
|
Метаболізм амінокислот у живих організмах.
Розпад білків
Головним, але можливо не єдиним шляхом розпаду білків в організмі є гідроліз. Гідролітичний розпад білків протікає в будь-якій клітині організму в основному в спеціальних субклітинних елементах — лізосомах, де зосереджені гідролітичні ферменти і де здійснюється деструкція високомолекулярних речовин до низькомолекулярних метаболітів.
В той же час певна частина ферментів, що каталізує розпад білків, є в цитозолі клітини, а деякі з них секретуються, забезпечуючи позаклітинне переварювання білків.
Гідроліз білків може бути частковим (до пептидів) і повним (до амінокислот). При частковому (неповному) гідролізі в білковій молекулі розпадаються лише деякі пептидні зв'язки, як правило, по сусідству із строго певними амінокислотними радикалами. Цей процес прискорюється специфічними ферментами — протеїназами (пептидил-пептидгидролазами). У свою чергу, пептиди гідролізуються до амінокислот, що відбувається за участю ряду пептидаз. Найбільш поширеними протеолітичними ферментами є: пепсин – у шлунку; у тонкій кишці – трипсин, хімотрипсин, карбокси- та амінопептидази, дипептидази.
Таким чином, в результаті дії пептидгідролаз (протеїназ і пептидаз) з білків в процесі їх гідролізу спочатку утворюються складні суміші різних пептидів, а потім суміш вільних білкових амінокислот. Останні є кінцевим продуктом гідролізу білків.
Катаболізм амінокислот до кінцевих продуктів обміну (СО2, Н2О і NH3) відбувається шляхом окислення їх через ряд ферментативних реакцій. Для окислення двадцяти різних амінокислот існує двадцять різних шляхів.
Але всі ці шляхи приводять до утворення невеликої кількості продуктів, які потім окислюються в циклі трикарбонових кислот або є попередниками для синтезу різних компонентів клітин.
|
|
|
Далі перетворення a-аміногрупи всіх амінокислот практично однакове. У ссавців амінний азот виводиться із організму у вигляді сечовини, сечової кислоти й аміаку.
Для катаболізму амінокислот характерні такі основні ознаки: всі амінокислоти можуть проходити через стадії: трансамінування, дезамінування, декарбоксилювання.
1. Розклад амінокислот за аміногрупою:
Трансамінування – перенесення аміногруп з амінокислоти на кетокислоти під дією амінотрансфераз, коферментом яких є фосфорний ефір вітаміну В6.
На певній стадії катаболізму не менш ніж у 11 амінокислот (ала, арг, асн, асп, цис, іле, ліз, фен, три, тир, вал) a-аміногрупа відщеплюється внаслідок ферментативної реакції трансамінування.
При цьому a-аміногрупа амінокислот переноситься до a-вуглецевого атома однієї з трьох a-кетокислот (піровиноградної, a-кетоглутарової або щавлево-оцтової), внаслідок чого утворюється a-кетоаналог вихідної амінокислоти, а a-кетокислота перетворюється у відповідну амінокислоту:
R1–CHNH2–COOH + R2–CO–COOH Û R1–CO–COOH + R2–CHNH2–COOH
Відомі дві найважливіші трансамінази, а саме, аланінтрансаміназа, що каталізує реакцію перенесення аміногрупи на піровиноградну кислоту, і глутаматтрансаміназа, що каталізує реакцію перенесення аміногрупи на a-кетоґлутарову кислоту.
Реакції, що каталізуються трансаміназами, оборотні, їх константа рівноваги дорівнює одиниці. Наслідком цих реакцій є те, що аміногрупи всіх амінокислот входять до складу глутамінової кислоти (у деяких організмів це може бути аспарагінова кислота або аланін).
В організмах, де найактивнішою є аланінтрансаміназа,a-аміногрупи всіх амінокислот накопичуються у вигляді аланіну, потім відбувається перенесення цих аміногруп від аланіну до a-кетоглутарової кислоти за участю ферменту аланін-глутаматтрансамінази.
|
|
|
Отже, незалежно від першої стадії трансамінування, кінцевим рецептором аміногруп більшості амінокислот є a-кетоглутарова кислота, що перетворюється в глутамінову кислоту, яка передає аміногрупи для кінцевих реакцій утворення продуктів азотистого обміну, наприклад сечовини.
Для дії трансаміназ необхідна наявність коферменту – піридоксальфосфату, що є похідним вітаміну В6. Альдегідна група коферменту має здатність реагувати з різними амінами, утворюючи основи Шиффа, або тетіміни.
Цикл трансамінування відбувається в дві стадії:
1) комплекс піридоксальфосфат-фермент приєднує аміногрупу від амінокислоти, утворюючи комплекс піридоксамінфосфат-ферменту; цей процес проходить через проміжне утворення двох основ Шиффа;
2) комплекс піридоксамінфосфат-фермент утворює основу Шиффа з a-кетокислотою і передає їй аміногрупу. Безперервно, переходячи з альдегідної форми в аміновану і навпаки, кофермент діє як переносник аміногрупи від амінокислоти до кетокислоти.
Механізм трансамінування можна представити такою схемою:
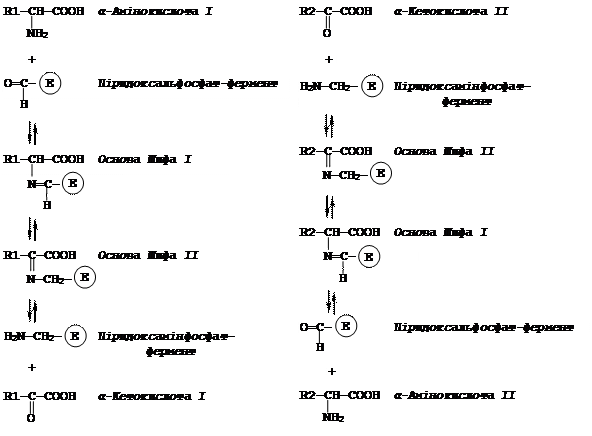 |
1.2. Дезамінування.
Найбільш поширеною і важливою реакцією амінокислот за α-аміногрупою є дезамінування.
Дезамінування – це процес відщеплення аміногрупи від амінокислоти з утворенням молекули аміаку.
Воно може йти чотирма шляхами:
§ окислювальне дезамінування,
§ відновне дезамінування,
§ гідролітичне дезамінування,
§ внутрішньомолекулярне переамінування.
Всі перераховані реакції здійснюються в організмах і кожна з них прискорюється специфічним ферментом; проте поширення їх в природі абсолютно різне: найбільш широко поширена реакція окислювального дезамінування, а останні три зустрічаються вкрай рідко, лише в окремих груп організмів.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 7746; Нарушение авторских прав?; Мы поможем в написании вашей работы!