
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кольчато-цепная (цикло-оксо-) таутомерия
 |
Изображенные линейными формулами альдозы (схема 2) во многом не отражают физические и химические свойства моносахаридов. Такие структуры возможны в растворах и то в незначительных количествах (тысячные доли процента). Так в УФ- и ИК-спектрах моносахаридов отсутствуют полосы поглощения, характеризующие карбонильную группу. Гексозы, например глюкоза, не дают реакций типичных для альдегидной группы, в частности, не обесцвечивают раствор фуксинсерной кислоты, не вступают в реакции с бисульфитом натрия и др.
Как показал А.А. Колли (русский химик-органик), в глюкозе, как и в других альдогексозах, не четыре, а пять гидроксилов. Колли предложил для всех моносахаридов циклические структуры. Появление пятого гидроксила, названного гликозидным, является следствием внутримолекулярной реакции между карбонильной группой и одним из гидроксилов моносахарида. Известно, что взаимодействие альдегидов со спиртами приводит к образованию 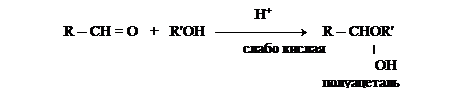 полуацеталей.
полуацеталей.
Например, образование полуацетальной формы глюкозы происходит вследствие взаимодействия альдегидной группы с гидроксилом при пятом атоме углерода, в результате образуется шестичленный цикл - глюкопираноза (название от
гетероцикла пиран  ), состоящий из пяти атомов углерода и одного атома кослорода. Если же цикл образуется с участием гидроксильной группы при четвертом атоме углерода, то образуются производные пятичленного кислородсодержащего
), состоящий из пяти атомов углерода и одного атома кослорода. Если же цикл образуется с участием гидроксильной группы при четвертом атоме углерода, то образуются производные пятичленного кислородсодержащего
гетероциклического соединения - фурана

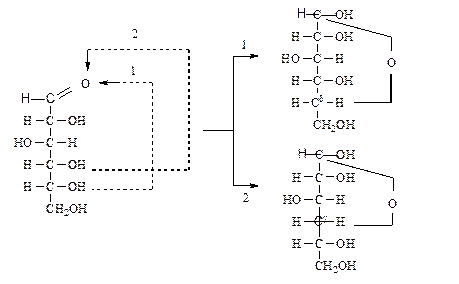 альдегидная форма
альдегидная форма
глюкозы
Таким образом, пятичленные монозы называются фуранозами (2), а шестичленные пиранозами (1). Возникновение циклических структур, существование которых предвидел Колли, обусловлено g- и d-оксициклотаутомерией.
|
|
|
Для более реального изображения моносахаридов как циклических полуацеталей используют перспективные формулы, предложенные в 1925 году английским химиком-органиком, лауреатом Нобелевской премии Н. Хеуорсом. Для перехода от проекционных формул Фишера к перспективным формулам Хеуорса поступают следующим образом. Все группы, которые в проекционной формуле Фишера расположены слева от углеродного скелета, в формуле Хеуорса располагаются сверху, а те группы, которые расположены в проекционной формуле Фишера справа от углеродного скелета, в формуле Хеуорса располагаются внизу. При этом гликозидный гидроксил может располагаться под плоскостью цикла рядом с гидроксилом при втором атоме углерода (в цис -положении). Такая структура отвечает α-D-глюкопиранозе (формула 1). Равновероятно, что в процессе образования полуацеталя может возникнуть структура, в которой гликозидный гидроксил может находиться в транс -положении по отношению к гидроксилу при втором атоме углерода, т.е. располагаться над плоскостью цикла. Такая структура отвечает β-D-глюкопиранозе (формула 2). α-D- и β-D-глюкопиранозы являются аномерами (от греческого ano – вверх). Аномеры – это изомеры циклических форм углеводов, отличающихся пространственным расположением гликозидных (полуацетальных) гидроксилов по отношению к плоскости цикла.
Циклические формулы углеводов изображают, по предложению Хеуорса, перспективными формулами.

D-глюкоза
(карбонильная форма)
1 - a-D-глюкопираноза, [a]D = +1120
2 - b-D-глюкопираноза, [a]D = +18,70
Присоединение гидроксила к карбонильной группе превращает ее атом углерода в асимметрический атом, следовательно, число оптических изомеров увеличивается в 2 раза: N = 25 = 32.
Аномеры α-D- и β-D-глюкопиранозы одновременно являются диастереомерами (пространственными изомерами), которые различаются свойствами, прежде всего, величинами углов удельного вращения [α]D поляризованного света. Оба изомера вращают поляризованный свет вправо, но на разные по величине углы. Поэтому глюкозу иногда называют декстрозой (от латинского dexter – правый).
|
|
|
Если в процессе образования полуацеталя участвовала гидроксильная группа при четвертом атоме углерода, то образуются α-D-глюкофураноза и β-D-глюкофураноза.
 b- D-глюкофураноза a-D-глюкофураноза
b- D-глюкофураноза a-D-глюкофураноза
Проекционные формулы Фишера для фруктозы имеют следующий вид:
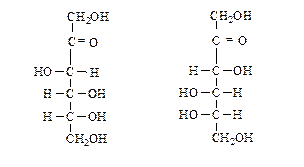
D-(-)-фруктоза L-(+)-фруктоза
Образование циклических структур в случае D-фруктозы можно отобразить следующей схемой:
 a-D-фруктофураноза D-фруктоза a-D-фруктопираноза
a-D-фруктофураноза D-фруктоза a-D-фруктопираноза
(открытая форма)
Используя выше приведенное правило, переходим к перспективным формулам Хеуорса:
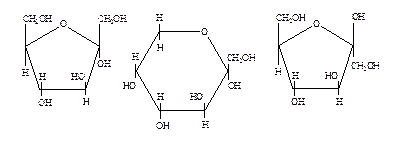
a-D(-)-фрукто- a-D-фруктопираноза b-D(-)-фрукто-
фураноза фураноза
[a]D = -63,60 [a]D = -135,50
α-D-фруктофураноза и β-D-фруктофураноза являются аномерами. В водных растворах фруктоза вращает поляризованный свет влево, поэтому ее еще называют левулеза.
Конформационная изомерия. Для моносахаридов полуацетальной структуры характерна конформационная (поворотная) изомерия, обусловленная различным расположением в пространстве атомов углерода, водорода и гидроксильных групп. Конформации (конформеры) полуацетальных моносахаридов представляют собой стереоизомерные структуры, находящиеся в подвижном равновесии, способные к различному превращению путем инверсии, выражающейся в выгибании и вращении вокруг σ-связей.
Циклы в ряду альдопираноз, подобно циклогексановому кольцу не плоские и существуют в виде нескольких (восьми) конформеров, среди которых термодинамически наиболее устойчивыми являются конформации кресла. α-D- и β-D-глюкопираноза представляют собой кресловидные структуры, изображаемые конформационными формулами 3 и 4 соответственно.
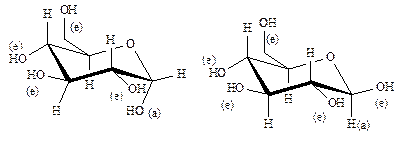
(3) (4)
a-D-глюкопираноза b-D-глюкопираноза
По сравнению с α-D-глюкопиранозой (3), β-D-глюкопираноза (4) термодинамически более устойчива и количественно преобладает в растворе равновесной смеси. В глюкопиранозе (4) все гидроксильные группы расположены экваториально (конформация еееее), между ними конформационные силы отталкивания сведены к минимуму. В то время, как существование некоторой доли конформера (3) стерически менее выгодно из-за расположения гликозидного гидроксила в аксиальном положении (конформация аееее). В α-D-глюкопиранозе имеет место так называемый аномерный эффект Δ2, являющийся следствием диполь-дипольного отталкивания между гетерокислородом цикла и гликозидным гидроксилом, вынужденным занять аксиальное положение (а).
|
|
|
В кристаллическом состоянии моносахариды существуют исключительно в виде циклических полуацеталей. При растворении в воде или действии химических реагентов происходит таутомеризация, в результате которой образуются открытые формы (карбонильные структуры), переходящие в пиранозные или фуранозные формы моносахаридов.
Пространственные изменения структуры после растворения называются мутаротацией моносахарида. Ход мутаротации можно проследить по изменению оптической активности, величины удельного угла вращения раствора моносахарида (схема 3). На схеме 3 показаны таутомерные превращения глюкозы. Процесс мутаротации ускоряется добавками к раствору небольших количеств аммиака. Так, угол вращения свежеприготовленного раствора α-D-глюкопиранозы, равный +112,20, постепенно уменьшается, доходя до величины равной +52,70.
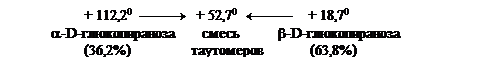
Аналогично угол удельного вращения свежеприготовленного раствора β-D-глюкопиранозы, равный +18,70, со временем возрастает, доходя до величины равной +52,70. В обоих случаях происходит мутаротация α-D- и β-D-глюкопиранозы соответственно. В результате в растворе устанавливается равновесная смесь, состоящая из α-D-глюкопиранозы (36,2%) и из термодинамически более устойчивой β-D-глюкопиранозы (63,8%).
Таутомерное превращение глюкозы.

1 – D(+)-глюкоза
2 - a-D-глюкопираноза - 36,2%
3 - b-D-глюкопираноза - 63,3%
4 - a-D-глюкофураноза
5 - b-D-глюкофураноза
Схема 3.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 4542; Нарушение авторских прав?; Мы поможем в написании вашей работы!