
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Структура углеводов
|
|
|
|
ВВЕДЕНИЕ
Углеводы – обширная группа природных органических соединений, составляющих основную часть пищи человека.
Оптимальным считается рацион, включающий 62% углеводов, 20% белка и 18% жира. Однако для большинства населения экономически развитых стран типична структура питания, включающая 45% углеводов, 10% белка и 45% жира. Для суточного рациона человека необходимо около 450-500 г углеводов, которые при распаде до углекислого газа и воды выделяют около 9210,9 кДж. Энергия используется в различных биологических процессах. Это их основная функция – энергетическая. Большую часть энергии использует центральная нервная система. Головной мозг потребляет глюкозы в два раза больше, чем мышцы и в три раза больше, чем почки. Нормальная деятельность поджелудочной железы и надпочечников также зависит от углеводов.
Но кроме энергетического назначения, углеводы осуществляют и пластическую функцию, так как входят в состав различных тканей организма. Например, в значительном количестве углеводы содержатся в костях, хрящах, в роговице и стекловидном теле глаза.
Вместе с белками углеводы образуют некоторые гормоны, ферменты, секреты. Углеводы входят в состав нуклеиновых кислот, участвуют в процессах свертывания крови.
Углеводы группы мукополисахаридов являются составными компонентами различных слизей, желудочного сока, слюны, семенной плазмы, межклеточного вещества и др. Мукополисахариды защищают органы и ткани от механических и химических повреждений.
Углеводы находят широкое использование в кондитерской, пищевой, медицинской промышленности, в сельском хозяйстве, для производства искусственных волокон, бумаги и т. д.
|
|
|
Потребность живых структур в углеводах удовлетворяется за счёт растительных продуктов (зерновых, картофеля, частично сахара и др.).
1.1. Классификация и номенклатура углеводов
Углеводы или сахариды – один из основных классов органических соединений, распространенных в природе. Они встречаются в растительных (до 80% сухой массы), животных (около 2% от сухой массы) и бактериальных организмах. Углеводы образуются в растениях за счет фотосинтеза в зеленом листе:

Название «углеводы» этот класс соединений получил в середине 19-го века. Оно исходит от того, что их состав выражается, как правило, общей формулой Сn(H2O)n, т.е. построены как бы из углерода и воды. В дальнейшем оказалось, что ряд соединений, принадлежащих по свойствам к классу углеводов, содержат водород и кислород в несколько ином соотношении, чем в общей формуле. Однако старое название «углеводы» прочно удерживается в науке.
Для углеводов обычно используются тривиальные названия. Для моносахаридов принята трёхбуквенная символика. Обозначения, принятые для наиболее важных моносахаридов приведены в таблице 1.
Таблица №1
Символика, используемая для записи важнейших моносахаридов и их
производных
| Название моносахаридов и их производных | Символы | Название моносахаридов и их производных | Символы |
| Глюкоза | Glc | Рибулоза | Rbu |
| Галактоза | Gal | Ксилулоза | Xlu |
| Манноза | Man | N-ацетилглюкозамин | Glc NAc |
| Фруктоза | Fru | N-ацетилгалактозамин | Gal NAc |
| Рибоза | Rib | Глюкуроновая кислота | Glc UA |
| Ксилоза | Xyl |
В зависимости от состава, строения и свойств углеводы классифицируют следующим образом:

Моносахариды содержат в своём составе от двух до девяти атомов углерода и представляют собой многоатомные спирты, включающие также карбонильную группу, т.е. они являются полигидроксиальдегидами или полигидроксикетонами. Поэтому моносахариды принято подразделять на альдозы и кетозы. Например, глюкоза – это альдоза, а фруктоза – это кетоза.
|
|
|
Моносахариды классифицируют также по числу атомов углерода в цепи. По этому признаку различают: триозы, тетрозы, пентозы и т. д. Наиболее распространены пентозы и гексозы. Если объединить оба типа классификации, то глюкоза будет альдогексозой, а фруктоза – кетогексозой:
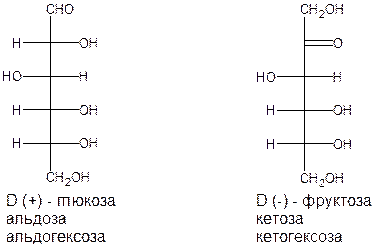
У всех биологически наиболее значимых кетоз оксогруппа расположена у второго атома углерода.
Известны моносахариды, у которых одна гидроксильная группа замещена на атом водорода. Это – дезоксисахара, которые содержат вместо – СН(ОН)-группу –СН2-. Наиболее важную роль среди них играет 2-дезокси-D-рибоза. Этот моносахарид входит в состав дезоксирибонуклеиновых кислот (ДНК), функции которых связаны с передачей наследственных признаков. Многие моно- и дидезоксисахара входят в состав антибиотиков.
В настоящее время известно значительное количество моносахаридов, в молекулах которых гидроксильные группы замещены другими группировками. Большое значение среди них имеют аминосахара, в которых одна из гидроксильных групп (чаще всего у второго углеродного атома) замещена на аминогруппу; например, N-ацетилглюкозамин имеет формулу:

Термин «олигосахариды» применяют к продуктам поликонденсации, содержащим несколько моносахаридных единиц (чаще всего гексоз). В зависимости от числа моносахаридных единиц, входящих в молекулу олигосахаридов, они делятся на дисахариды, трисахариды и т. д.
Среди олигосахаридов наибольший интерес представляет группа широко распространённых в природе дисахаридов, многие из них имеют большое практическое значение. Дисахариды образуются при конденсации двух моносахаридов с отщеплением молекулы воды. Дисахариды, как и моносахариды, представляют собой белые кристаллические вещества, растворимые в воде и имеющие сладкий вкус.
Полисахариды состоят из большого числа остатков моносахаридов и их производных. Различают гомополисахариды и гетерополисахариды. Гомополисахариды состоят из остатков одного и того же моносахарида, а гетерополисахариды – из остатков моносахаридов двух или более типов.
|
|
|
Сахара встречаются в природе также и в виде соединений, в которых они связаны с несахарами – обычно это оксисоединения или азотистые основания. Соединения такого типа называются гликозидами.
1.2. Проекционные формулы углеводов
Рассмотрим их на примере глюкозы, т.к. многое из относящегося к глюкозе справедливо и для других моносахаридов.
Немецкий химик Э.Фишер, занимавшийся изучением углеводов, придал моносахаридам открытую структуру, т.к. они дают почти все реакции оксосоединений (альдегидов и кетонов). Основную цепь атомов углерода изображают вертикальной линией с наиболее окисленным углеродом наверху и гидроксиметильной группой внизу. По правилам фишеровской проекции тетраэдрический атом углерода располагают таким образом, чтобы его четыре связи проектировались на плоскость в виде креста. Причем, связи, находящиеся над плоскостью бумаги, образуют горизонтальную линию, а уходящие под плоскость бумаги – вертикальную. Фишеровская проекция D-глюкозы:

Углеродные атомы 2, 3, 4, 5 асимметричны, поэтому для цепной структуры возможно существование 24=16 стереоизомерных форм (число стереоизомеров равно 2 n, где n – число хиральных центров). Все они известны. Конфигурация С-5 аналогична конфигурации D-(+)- глицеринового альдегида. Если в моносахариде конфигурация асимметрического атома углерода наиболее удаленного от карбонильной группы совпадает с конфигурацией асимметрического атома углерода в L-(-)- глицериновом альдегиде, то тогда моносахарид принадлежит к L – ряду.
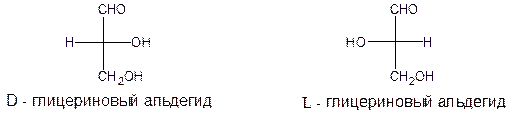

Большинство природных моносахаридов относится к D- ряду; структурные еденицы олиго- и полисахаридов и других природных веществ являются также, преимущественно, моносахаридами D - ряда. Генетические D- ряды альдоз и кетоз приведены в таблицах 2,3.
Таким образом, буквами D или L обозначают принадлежность моносахарида к D- или L- ряду, сравнивая положение заместителей у наиболее удаленного от карбонильной группы атома углерода, с глицериновым альдегидом.
D и L – глюкозы представляют зеркальное отображение друг друга и поэтому являются парами энантиомеров. Физические и химические свойства пары энантиомеров одинаковы, за исключением взаимодействия с плоскополяризованным светом и хиральными реагентами.
|
|
|
Когда плоскополяризованный свет проходит через кювету с образцом одного энантиомера, плоскость поляризации поворачивается вправр или влево. Другой энантиомер в тех же условиях (температура, растворитель, концентрация) вращает плоскость поляризации света на такой же угол, но в противоположном направлении. Это явление называют оптической активностью.
Энантиомер, который вращает плоскость поляризации вправо (по часовой стрелке), если смотреть на источник света, принято называть правовращающим, или (+) – энантиомером. Другой энантиомер, вращающий влево (против часовой стрелки), обозначают как левовращающий, или (-) – энантиомер.
Моносахариды, относящиеся по стереохимической конфигурации к D - ряду, могут быть и право- и левовращающими. Например, природная глюкоза, относящаяся к D-ряду, является правовращающей, а природная форма D- фруктозы - левовращающей. Величина удельного вращения, т.е. угла поворота плоскости поляризованного луча света при прохождении через кювету толщиной 1 см с раствором вещества, имеющего концентрацию 1 моль/л, определяется только природой растворенного вещества (при определенной температуре, растворителе и длине волны проходящего света).
Величину удельного вращения обозначают как [α]θ λ , где λ – длина волны поляризованного света (обычно это D – линия натрия, 589 нм), а θ – температура в градусах Цельсия, при которой проводится измерение. Обычно измерения удельного вращения проводят при комнатной температуре, поэтому часто встречается обозначение [α]20D. Если вращение измеряют в растворе, то необходимо учитывать растворитель.
Для экспериментального определения угла оптического вращения используется специальный прибор – поляриметр. Некоторые конструкции приборов специально предназначены для количественного определения дисахарида – сахарозы. Шкала таких приборов градуирована не в круговых градусах, а в градусах международной сахарной шкалы, по которой 1 градус соответствует содержанию 0,26 г сахарозы в 100 см3 раствора.
Глюкоза обнаруживает некоторые свойства, характерные для альдегидов, которые подтверждают справедливость формулы Фишера, согласно которой глюкоза имеет открытую структуру. Например, как это показано в разделе 2, глюкозу можно восстановить в шестиатомный спирт – сорбит (реакция I); окислить действием бромной воды до монокарбоновой кислоты – D-глюконовой (II).
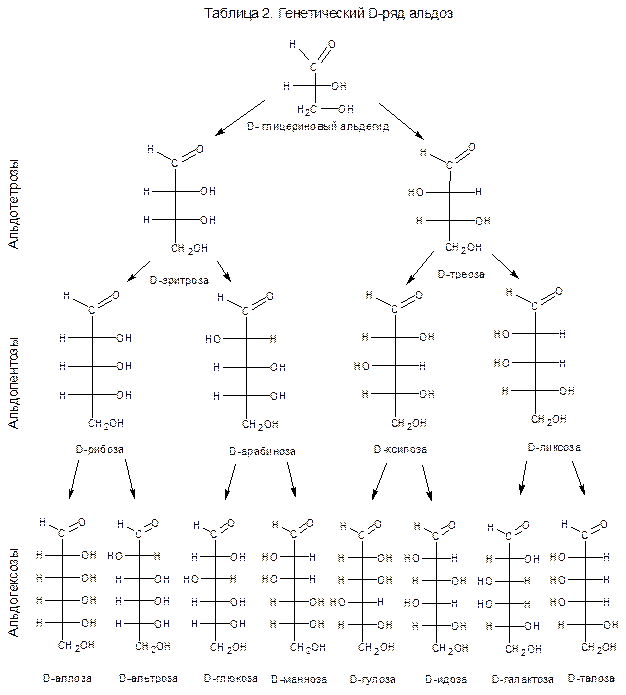

Азотная кислота окисляет глюкозу до дикарбоновой кислоты – D- глюкаровой (III). Кроме перечисленных реакций, глюкоза подобно оксосоединениям образует ряд производных по карбонильной группе – циангидрин, оксим, фенилгидразон (соответственно реакции IV, VIII, XII).
Однако в отличие от альдегидов, глюкоза не способна к образованию бисульфитных производных. Кроме того, при алкилировании йодистым метилом или диметилсульфатом в щелочной среде (XV, XVI), глюкоза получает пять метильных групп. Пентаметилглюкоза теряет способность к реакциям альдегидов. Более того, одна метильная группа отличается по свойствам от остальных. Например, она легко гидролизуется разбавленными кислотами (XVII), и после этого, к глюкозе, еще имеющей четыре метильные группы, возвращаются свойства альдегидов (XVIII).
Еще один факт: глюкоза имеет не 16 стереоизомеров (восемь пар антиподов), как это следует из ее цепной структуры, а 32 (16 антиподных пар). Следовательно, цепная структура не учитывает наличие еще одного асимметрического углеродного атома.
Вышеперечисленные данные служат доводом в пользу циклической структуры глюкозы. В действительности существует равновесие между открытой структурой моносахаридов и циклической, т.е для них характерна оксо-цикло-таутомерия. Эта таутомерия называется также кольчато-цепной.
Циклическая структура в виде полуацеталей или полукеталей образуется в результате внутримолекулярной реакции взаимодействия сближенных в пространстве гидроксильной группы с карбонильной. В общем виде образование полуацеталя (а) и циклического полуацеталя (б) можно представить следующим образом:
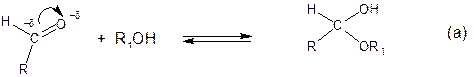


Внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов. Образование малых циклов (например, четырехчленных) энергетически невыгодо из-за байеровского напряжения. Образование больших циклов (например, семичленных) невугодно по причине тормонных дестабилизирующих взаимодействий.
В случае глюкозы более устойчивый ацеталь образуется с участием гидроксильной группы при пятом углеродном атоме. Эту форму D-глюкозы называют D-глюкопиранозой (по аналогии с шестичленным насыщенным кислородсодержащим гетероциклом – тетрагидропираном  )
)
В циклической форме появляется новый хиральный центр (С-1), называемый аномерным атомом углерода или аномерным центром.
Положение вновь возникшей гидроксильной группы обозначают с помощью букв α и β. Если в формуле Фишера аномерный углерод имеет такую же конфигурацию, что и связь С5-О, то структуру обозначают как α – аномер; если же новая ОН-группа находится с противоположной стороны по отношению к связи С5-О, то это β – аномер.

Аномерную пару можно рассматривать как частный случай эпимерной пары. Эпимеры – это пара стереоизомеров, содержащих несколько хиральных центров, но отличающихся конфигурацией только одного из этих центров. α- и β- Формы не являются оптическими антиподами, а представляют собой диастереомеры. Таким образом, каждый из восьми изомеров D-ряда и восьми изомеров L- ряда будет иметь по две стереоформы: α и β.
Пиранозную форму сахаров удобнее изображать в виде структур Хеуорса. В структурах Хеуорса кислородный атом шестичленного гетероцикла располагают в правом верхнем углу. Гидроксильные группы и атомы водорода, расположенные с правой стороны цепочки в формулах Фишера, размещают в формулах Хеуорса под плоскостью кольца, а находящиеся с левой стороны цепочки – над плоскостью кольца.
В формулах Хеуорса отнесение к α - или β – форме зависит от того, каким образом в пространтсве располагаются гликозидная гидроксильная группа (у С-1) и гидроксильная группа (или гидроксиметильная СН2ОН) у атома углерода, определяющего принадлежость К D- или L- ряду (для пентоз-четвертого, для гексоз – пятого). Для фуранозных и плоских пиранозных структур цис- расположение этих групп определяет β – форму, а транс – расположение - α – форму.
Открытые и циклические структуры Фишера, пиранозные структуры Хеуорса для α - и β- аномеров соответственно D- и L – глюкозы приведены на рис. 1 и 2.
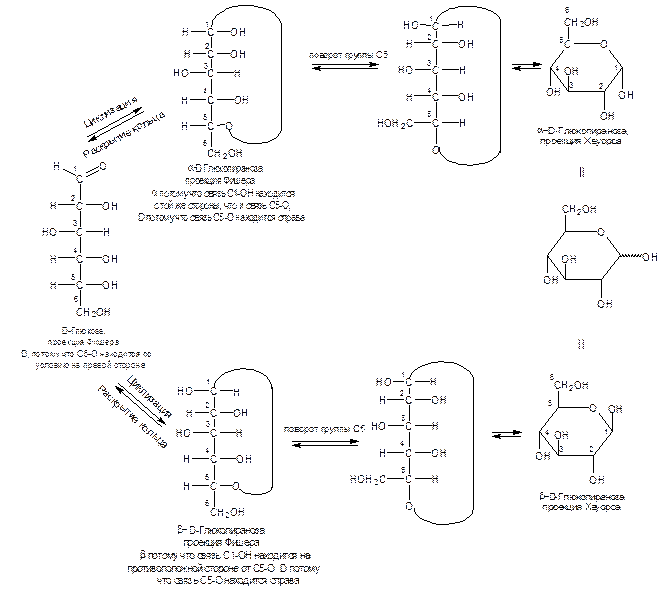
Рис.1

Рис. 2
Сахара типа треозы и эритрозы состоят из четырех атомов углерода, поэтому они не могут, подобно глюкозе, образовывать шестичленный кислородсодержащий цикл. Указанные альдотетрозы образуют пятичленные кислородсодержащие циклы. Эти циклические полуацетали называют по аналогии с тетрагидрофураном ( ) – фуранозами:
) – фуранозами:
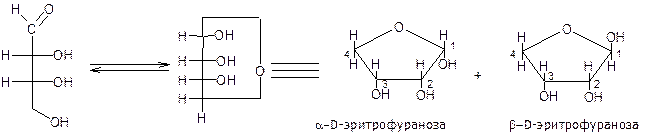
эритроза
Пиранозная форма является предпочтительной для альдогексоз, фуранозная является единственно возможной для альдотетроз. Альдопентозы образуют фуранозные и пиранозные формы, но в силу большей устойчивости, предпочтительной являются пиранозные структуры.
В живых организмах молекулы моносахаридов всегда находятся в циклической форме, в таком же виде лстатки сахаров входят в состав полисахаридов. В твердом состоянии сахара также имеют циклическое строение. Только в растворе появляются кроме циклических еще и нециклические формы молекул. При этом последних в растворе мало, около 1%. В природе среди циклических форм сахаров в основном встречаются пиранозы, фураноз очень мало (рибоза, фруктоза).
1.3 Конформация углеводов
Приведенные выше формулы Хеуорса α- и β- форм D – глюкозы не дают представления о их пространственном строении. Пиранозное кольцо, так же как и кольцо циклогексана, в действительности не является плоским, а существует в конформациях кресла или ванны. Как правило, форма кресла энергетически более выгодная.
Рентгеноструктурный анализ показал, что шестичленная циклическая окисная структура сахаров существует, преимущественно, в форме кресла. Например, кристаллическая α-D-глюкоза имеет структуру (а), а кристаллическая β-D-глюкоза – структуру (б):
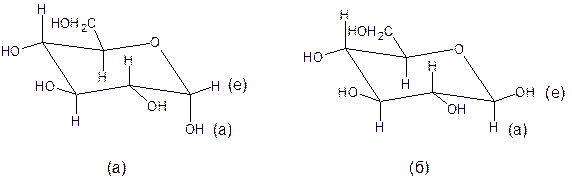
Заместители у атомов углерода в конформациях кресла оказываются либо аксиальными (а), либо экваториальными (е).
У α – аномеров расположение в пространстве гликозидной гидроксильной группы (у С – 1) и гидроксильной (или гидроксиметильной) группы у атома углерода, определяющего принадлежность к D – ряду L – ряду (для пентоз – четвертого, для гексоз – пятого) неодинаковое: аксиальная – экваториальная, экваториальная – аксиальная). Одинаковая ориентация (аксиальная – аксиальная, экваториальная – экваториальная) определяет β – форму.
Гидроксильная группа при С-1 аксиальна в α-форме и эваториальна в β-форме, следовательно, β-аномер более устойчив.
Кристаллические формы α- и β- D – глюкозы вполне устойчивы. Однако в водном растворе постепенно устанавливается равновесие обеих форм. За этим процессом можно проследить по уменьшению удельного вращения α- аномера (+1100) или по возрастанию удельного вращения β-аномера (+19,30) до равновесного значения, составляющего +520. Это явление изменения оптического вращения растворов моносахаридов при стоянии (во времени) называется мутаротацией. Явление мутаротации связано с тем, что каждый кристаллический препарат сахара представляет собой какую-либо одну циклическую форму. При растворении в воде и стоянии растворов эта форма через альдегидную превращается в другую таутомерную циклическую форму до достижения состояния равновесия. При этом удельное вращение, характерное для исходной циклической формы, постепенно меняется и, наконец, устанавливается постоянное удельное вращение, характерное для равновесной смеси таутомеров. В равновесной смеси присутствует примерно 64% β-аномера D-глюкозы и примерно 36% α-аномера. Количество свободной альдегидной формы в нейтральном растворе невелико и составляет примерно 0,024 мол.%.
|
|
|
|
|
Дата добавления: 2015-07-13; Просмотров: 4659; Нарушение авторских прав?; Мы поможем в написании вашей работы!