
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. 1) Si +O2 = SiO2 2) Si + 2Cl2 = SiCl4 3) Si +2S = SiS2
|
|
|
|
1) Si +O2 = SiO2 2) Si + 2Cl2 = SiCl4 3) Si +2S = SiS2
4) Si + C =SiC 5) Si + Ca = Ca2 Si 6) Si+ 2H2 O г = SiO2 + 2H2
7) Si +2NaOHконц + H2 O = Na2SiO3 +2H2
6. Соединения кремния SiO2 -оксид кремния(IV) речной песок
Твердое, тугоплавкое, кристаллическое вещество, не растворяется в воде.
Химические свойства Общие свойства с другими кислотными оксидами
1) SiO2 + MeO → MeSiO3 2) SiO2 + MeOH → MeSiO3 + H2 O
II. Специфические
1) SiO2 не взаимодействует с H2 O 2) SiO2 + CaCO3 = CaSiO3 + CO2
Кремниевая кислота
Получение. Na2SiO3 + 2HCl = 2NaCl + H2.
Слабая кислота, нерастворима в воде, выпадает в осадок в виде студенистого вещества.
Химические свойства.
1) При нагревании:H2SiO3= SiO2 + H2 O
2) Действие на индикаторы не обнаруживает, т.к. нерастворима.
Гидролиз солей
| ОКРАСКА ИНДИКАТОРА В РАЗЛИЧНЫХ СРЕДАХ | |||||||||||||||||||||||||||||||||||||||||||||
· Сильные электролиты: · кислоты HCl, HBr, HI, HNO3, H2SO4, НClO4, · основания – щёлочи LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).). Слабые: · CH3COOH,H2CO3, H2S Средней силы -H3PO4 · все нерастворимые в воде основания и NH4OH
|
6.зависит от давления – для газовых реакций, при увеличении давления повышается концентрация газов.
|
|
|
7. от степени измельчения – для твердых веществ, т.к. при измельчении увеличивается площадь соприкосновения.
Пример1. Для увеличения скорости химической реакции  необходимо
необходимо
1) увеличить температуру
2) добавить иодоводород
3) уменьшить давление
4) увеличить объем реакционного сосуда
Ответ: Увеличение температуры увеличивает скорость химической реакции.
Пример 2. Для увеличения скорости химической реакции
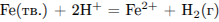
необходимо
1) увеличить концентрацию ионов железа
2) размельчить железо
3) уменьшить температуру
4) уменьшить концентрацию кислоты
Скорость химической реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для реагентов, которые находятся в разных фазах, например, жидкие и твердые; твердые и газообразные).
Ответ:Если размельчить железо, то увеличится площадь соприкосновения реагентов, поэтому скорость реакции возрастет.
Пример 3.Для увеличения скорости реакции гидролиза этилацетата необходимо
1) добавить уксусную кислоту
2) добавить этанол
3) нагреть раствор
4) увеличить давление
Ответ:Для увеличения скорости реакции можно
- увеличить температуру,
- увеличить концентрацию исходных веществ,
- увеличить площадь соприкосновения веществ (для гетерогенных реакций),
|
|
|
- увеличить давление (для реакций с газообразными реагентами),
- добавить катализатор.
этилацетат + вода = этиловый спирт и уксусная кислота.
ответ: нагреть раствор
классифиция химических реакции
I. По числу и составу исходных и образующихся веществ:
· Реакции разложения – реакции, в результате которых из одного сложного вещества образуются несколько простых или сложных веществ:
CaCO3 = CaO + CO2 2H2O =2H2 + O2
· Реакции соединения – реакции, когда из двух или нескольких веществ образуется одно новое вещество: SO3 + H2O = H2SO4 2Mg + O2 = 2MgO.
· Реакции замещения – это реакции между простым и сложным веществами, при которых атомы простого вещества замещают атомы одного из элементов в сложном веществ CuSO4 + Fe = FeSO4 + Cu H2 + CuO = Cu + H2O
· Реакции обмена – реакции, протекающие между сложными веществами, при которых они обмениваются своими составными частями. Обычно этот термин применяют для реакций с участием ионов, находящихся в водном растворе:
CuO + 2HCl = CuCl2 + H2O NaOH + HCl = NaCl + H2O
2)По изменениям степеней окисления элементов
· без изменения степеней окисления AgNO3 + HCl = AgCl- + HNO3,
· окислительно-восстановительными:2Mg + CO2-= 2MgO + C
C+4 + 4e ® C0 – процесс окисления Mg0 – 2e ® Mg+2 – процесс восстановления
3.По тепловому эффекту
· экзотермические, идущие с выделением тепла: N2 + 3H2 = 2NH3 + Q,
· эндотермические, идущие с поглощением тепла: N2 + O2 = 2NO – Q. Количество теплоты, которое выделяется или поглощается при химических реакциях, называется тепловым эффектом реакции. Химические уравнения, в которых указывается количество выделенной или поглощённой кислоты, называются термохимическими уравнениями.
4. По направлению протекания реакции
· необратимые реакции, которые протекают до конца. Относят реакции горения, а также реакции, сопровождающиеся образованием осадка или газа C + O2 = CO2
KClO3 = 2KCl + 3O2 BaCl2 + H2SO4 = 2HCl + BaSO4
· обратимые, протекающие при данных условиях в противоположных направлениях. В уравнениях таких реакций знак равенства заменяется двумя противоположно направленными стрелками.Среди двух одновременно протекающих реакций различают прямую( протекает "слева направо") и обратную (протекает "справа налево").
2SO2 + O2 = 2SO3 N2 + 3H2 =2NH3 N2 + O2 =2NO – Q
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1712; Нарушение авторских прав?; Мы поможем в написании вашей работы!
