
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Подгруппа меди.Общая характеристика элементов
|
|
|
|
Подгруппа меди
Подгруппа меди.Общая характеристика элементов. Способы получения и свойства.
Подгру́ппа ме́ди — химические элементы 11-й группы периодической таблицы химических элементов. В группу входят переходные металлы, из которых традиционно изготавливают монеты:медь Cu, серебро Ag и золото Au. На основании строения электронной конфигурации, к этой же группе относится и рентгенийRg,
Медь и её соединения.
Получение
Пирометаллургия:
CuO + C  Cu + CO
Cu + CO
CuO + CO  Cu + CO2
Cu + CO2
Гидрометаллургия:
CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
CuSO4 + Fe  FeSO4 + Cu
FeSO4 + Cu
Электролиз:
2CuSO4 + 2H2O  2Cu + O2
2Cu + O2 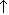 + 2H2SO4
+ 2H2SO4
(на катоде) (на аноде)
Взаимодействует с неметаллами при высоких температурах:
2Cu + O2  2CuO
2CuO
Cu + Cl2  CuCl2
CuCl2
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.)  3Cu(NO3)2 + 2NO
3Cu(NO3)2 + 2NO 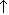 + 2H2O
+ 2H2O
Cu + 4HNO3(конц.)  Cu(NO3)2 + 2NO2
Cu(NO3)2 + 2NO2 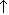 + 2H2O
+ 2H2O
Cu + 2H2SO4(конц.)  CuSO4 + SO2
CuSO4 + SO2 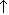 +2H2O
+2H2O
Сплавы меди с оловом - бронзы, с цинком - латуни.
Соединения одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S, CuCl), либо в виде растворимых комплексов (координационное число меди – 2):
CuCl + 2NH3  [Cu(NH3)2]Cl
[Cu(NH3)2]Cl
Оксид меди (I) - красного цвета, получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH  Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Соединения двухвалентной меди
Оксид меди (II) - чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
CuO + 2HNO3  Cu(NO3)2 + H2O
Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
|
|
|
CuSO4 + 2NaOH  Cu(OH)2
Cu(OH)2  + Na2SO4
+ Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2  CuO + H2O
CuO + H2O
Типичное основание. Растворяется в кислотах.
Cu(OH)2 + 2HCl  CuCl2 + 2H2O
CuCl2 + 2H2O
Cu(OH)2 + 2H+  Cu2+ + 2H2O
Cu2+ + 2H2O
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3  [Cu(NH3)4](OH)2
[Cu(NH3)4](OH)2
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O  Cu2(OH)2CO3
Cu2(OH)2CO3  + 2Na2SO4 + CO2
+ 2Na2SO4 + CO2 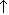
Разложение малахита:
Cu2(OH)2CO3  2CuO + CO2
2CuO + CO2 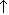 + H2O
+ H2O
Дополнительную информацию о меди, её свойствах и применении можно получить здесь
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1030; Нарушение авторских прав?; Мы поможем в написании вашей работы!