
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Блок – Химия
|
|
|
|
61. Плотность некоторого газа при нормальных условиях равна 1,25 кг/м3. Определите его молекулярную массу. Что это может быть за вещество?
m=1,25кг/дм3 * 22,4л=28 кг
где P(давление)=101,3 кПа, Т=298К, R=8,31дж/к, V=22.4 л
М=  г/моль
г/моль
Вещество азот.
62. Плотность некоторого газа при нормальных условиях равна 1,43 кг/м3. Определите его молекулярную массу. Что это может быть за вещество?
m=1,43кг/дм3 * 22,4л=32,032 кг
где P(давление)=101,3 кПа, Т=298К, R=8,31дж/к, V=22.4 л
М= 

Вещество кислород.
63. Плотность некоторого газа при нормальных условиях равна 1,96 кг/м3. Определите его молекулярную массу. Что это может быть за вещество?
m=1,96кг/дм3 * 22,4л=43,904 кг
где P(давление)=101,3 кПа, Т=298К, R=8,31дж/к, V=22.4 л
М= 

Вещество углекислый газ.
64. Плотность некоторого газа при нормальных условиях равна 0,71 кг/м3. Определите его молекулярную массу. Что это может быть за вещество?
m=1,96кг/дм3 * 22,4л=43,904 кг
где P(давление)=101,3 кПа, Т=298К, R=8,31дж/к, V=22.4 л
М= 

Вещество углекислый газ.
65. Плотность некоторого газа при нормальных условиях равна 0,09 кг/м3. Определите его молекулярную массу. Что это может быть за вещество?
m=0,09кг/дм3 * 22,4л=2,016 кг
где P(давление)=101,3 кПа, Т=298К, R=8,31дж/к, V=22.4 л
М= 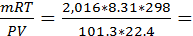

Вещество водород.
66. Плотность некоторого газа при нормальных условиях равна 0,18 кг/м3. Определите его молекулярную массу. Что это может быть за вещество?
m=0,18кг/дм3 * 22,4л=4,032 кг
где P(давление)=101,3 кПа, Т=298К, R=8,31дж/к, V=22.4 л
М= 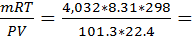

Вещество гелий.
67. Смесь водорода и азота (3:1 по объему) пропустили через платиновый катализатор, что привело к снижению давления газовой смеси на 10%. Какое вещество образуется в этих условия? Определите степень конверсии.
|
|
|
68. Какие вещества образуется при взаимодействии соляной кислоты с гидрокарбонатом натрия. Напишите уравнение реакции. Рассчитайте соотношение масс реагирующих веществ.
NaHCO3 + HCl = NaCl + CO2 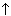 + H2O; реакция в выделением газа (углекислого).
+ H2O; реакция в выделением газа (углекислого).
69. Что образуется при взаимодействии карбоната кальция с угольной кислотой? Напишите уравнение реакции. Рассчитайте соотношение масс реагирующих веществ.
CaCO3 + H2CO3 = Ca(HCO3)2 + CO2; реакция в выделением газа (углекислого).
Гидрокарбонат кальция — соль угольной кислоты. Химическая формула — 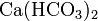
70. Что такое изотопы? Приведите примеры.
ИЗОТОПЫ – разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу.
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2H и 3H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1H называют иногда протием).
71. Рассчитайте массу 1 атома углерода.
72. При каких условиях в воздухе может образоваться окись азота
Оксиды азота поступают в атмосферу от промышленных предприятий, электростанций, печей и котельных, а также от автотранспорта. Они могут образовываться и поступать в атмосферу в больших количествах при производстве минеральных удобрений. В атмосфере выбросы оксидов азота трансформируются в диоксид азота. Диоксид азота является важной составляющей фотохимических процессов в атмосфере, связанных с образованием озона при солнечной погоде. При небольших концентрациях диоксида азота наблюдается нарушение дыхания, кашель. Всемирная Организация Здравоохранения установила, что при средней за час концентрации диоксида азота, равной 400 мкг/куб.м., наблюдаются болезненные симптомы у больных астмой и других групп людей с повышенной чувствительностью. При средней за год концентрации, равной 30 мкг/куб.м., увеличивается число детей с учащенным дыханием, кашлем и больных бронхитом.
|
|
|
73. Рассчитайте молекулярную массу карбоната кальция.
Карбонат кальция - CaCO3. Его молекулярная масса есть сумма молекулярных масс составляющих его атомов элементов.
М (СаСО3)=М (Са) +М (С) +3М (О) =40+12+3*16=100 атомных единиц массы (а. е. м.)
74. Приведите примеры соединений, для которых характерны: Неполярная и полярная ковалентная связь.
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: (на схеме электроны обозначены точками).

б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:

75. Ионная связь и Водородная связь.
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом.
(например, в соединениях CsF, NaBr, K2O, Rb2S, Li3N и др.).
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (Например, водородные связи имеются в HF, Н2О, NH3, но их нет в HCl, Н2S, PH3)
76. Почему металлы проводят электрический ток?
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов.
77. Почему природные воды проводят электрический ток?
Электропроводность - это численное выражение способности водного раствора проводить электрический ток. Электрическая проводимость природной воды зависит в основном от концентрации растворенных минеральных солей и температуры. Природные воды представляют в основном растворы смесей сильных электролитов. Минеральную часть воды составляют ионы Na+, K+, Ca2+, Cl-, SO42-, HCO3-. Этими ионами и обуславливается электропроводность природных вод.
|
|
|
78. Почему поваренная соль растворяется в воде и не растворяется в бензине?
Бензин - неполярный растворитель, в нём растворяться не будет. Неполярные вещества – это соединения, молекула которых диполем не является. Они не растворяют соли и основания.
79. Как Вы считаете, почему мыло помогает смывать жировые загрязнения?
Как у всех солей, у мыла полярные молекулы. Как все соли, в водном растворе молекула мыла дает положительный ион того же натрия или калия, за счет большой длины молекулы один его конец, где “сидит” заряд, является гидрофильным, а другой конец – нейтральным и, соответственно, гидрофобным
Гидрофобная часть молекулы мыла проникает в гидрофобное загрязняющее вещество (жир), в результате чего поверхность каждой частицы или капельки загрязнения оказывается как бы окруженной оболочкой из гидрофильных групп. Гидрофильные группы взаимодействуют с полярными молекулами воды. Благодаря этому молекулы моющего средства вместе с загрязнением отрываются от поверхности ткани и уходят в водную среду. Моющая способность мыла усиливается благодаря тому, что при гидролизе мыла образуется щелочь, которая обладает эмульгирующим свойством. R–СОО–Nа + Н-ОН —> R–СООН+ NаОН
80. Приведите примеры типичных металлов (доноров электронов) и типичных неметаллов (акцепторов электронов).
Как известно, атомы металлов (Na, Ca, Mg и т. д., все элементы I группы) легко отдают электроны (доноры электронов), а атомы неметаллов (кислорода, фтора, хлора и др.) легко их присоединяют (они - акцепторы электронов). В результате оба взаимодействующих атома превращаются в ионы с электронной оболочкой ближайшего к ним инертного газа, т. е. с наиболее устойчивой восьми-электронной конфигурацией этой внешней оболочки. Поскольку оба иона имеют разноименные заряды, они притягиваются друг к другу за счет электростатических сил. Такая связь весьма прочна
|
|
|
81. Чем строение жидкости отличается от строения твердых тел и газов?
Различные свойства вещества во всех состояниях определяются тем, что его молекулы расположены иначе и движутся по-разному.
Если газ сжимается и объем его уменьшается, следовательно, в газах расстояние между молекулами намного больше размеров самих молекул. Поскольку в среднем расстояния между молекулами в десятки раз больше размера молекул, то они слабо притягиваются друг к другу. Поэтому газы не имеют собственной формы и постоянного объема.
Молекулы жидкости расположены близко друг к другу. Расстояния между каждыми двумя молекулами меньше размеров молекул, поэтому притяжение между ними становится значительным.
В твердых телах молекулы (атомы) расположены в определенном порядке. Это лед, соль, металлы и др. Такие тела называются кристаллами. Молекулы или атомы твердых тел колеблются около определенной точки и не могут далеко переместиться от нее. Твердое тело поэтому сохраняет не только объем, но и форму.
82. Какие физические и химические свойства воды Вы знаете? В чем причина аномальных свойств воды?
Физические: чистота, цвет, запах, вкус, температура плавления (кипения), поверхностное натяжение, жесткость, теплопроводность, теплоёмкость, плотность, электропроводность.
ХИМИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА – это свойства, которые проявляются в результате химических реакций.
При взаимодействии воды с большинством металлов происходит реакция с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
При воздействии электрическим током вода разлагается на водород и кислород. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
Вода вступает в реакцию со многими оксидами неметаллов и некоторыми оксидами металлов. Это не окислительно-восстановительные реакции, а реакции соединения:
SO2 + H2O = H2SO3 (сернистая кислота)
Вода образует соединения, гидраты и кристаллогидраты, в которых полностью сохраняется молекула воды. Например:
CuSO4 + 5 H2O = CuSO4.5H2O
ода участвует в био-синтезе в результате, которого образуется кислород:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
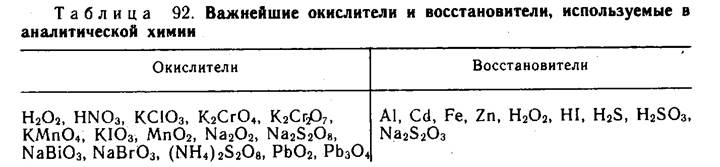
83. Важнейшие окислители и восстановители.
Окислителями называют вещества, принимающие электроны от другого вещества, а восстановителями — вещества, отдающие электроны другому веществу
84. Какой металл по-вашему активней, калий или кальций? Почему?
Активней калий, меньше заряд ядра, больше радиус атома, электрон с последнего энергетического уровня легче отдается, активность металла растет.
Также в таблице электрохимического ряда напряжений металлов (она характеризует их активность в ОВР) Калий стоит левее Кальция, значит он активнее.
85. Что такое коллоиды? Приведите примеры коллоидных растворов.
Коллоидные системы относятся к дисперсным системам – системам, где одно вещество в виде частиц различной величины распределено в другом.
Коллоидные частицы не оседают под действием силы тяжести, проходят через бумажные фильтры; но они невидимы в обычный микроскоп. Коллоидные растворы обычно называют золями. В зависимости от природы дисперсионной среды золи называют гидрозолями – дисперсионная среда – жидкость, аэрозолями – дисперсионная среда воздух.
Виды:
дым — взвесь твёрдых частиц в газе.
туман — взвесь жидких частиц в газе.
аэрозоль — состоит из мелких твёрдых или жидких частиц, взвешенных в газовой среде
пена — взвесь газа в жидкости или твёрдом теле.
эмульсия — взвесь жидких частиц в жидкости.
золь,
лиозоль — золь с жидкостью в качестве дисперсионной среды.
гель —
суспензия — взвесь твёрдых частиц в жидкости.
золи - дым, пыль
гели - мармелад, желе, кисель
86. Опишите физические и химические свойства углекислого газа.
Химические свойства. В химическом отношении углекислый газ инертен. Образовавшись с выделением большого количества тепла, он, как продукт полного окисления углерода, весьма стоек. Реакции восстановления двуокиси углерода протекают только при высоких температурах. Так, например, взаимодействуя с калием при 230° С, углекислый газ восстанавливается до щавелевой кислоты:
Вступая в химическое взаимодействие с водой, газ, в количестве не более 1% от содержания его в растворе, образует угольную кислоту, диссоциирующую на ионы Н+, НСО3-, СО23-. В водном растворе углекислый газ легко вступает в химические реакции, образуя различные углекислые соли. Поэтому водный раствор углекислого газа обладает большой агрессивностью по отношению к металлам, а также разрушающе действует на бетон.
Физические свойства. Для сатурации напитков используется углекислый газ, приведенный в жидкое состояние сжатием до высокого давления. В зависимости от температуры и давления углекислый газ может находиться также в газообразном и твердом состоянии.
При температуре минус 56,6° С и давлении 0,52 Мн/м2 (5,28 кГ/см2), соответствующих тройной точке, углекислый газ может одновременно находиться в газообразном, жидком и твердом состоянии. При более высоких температуре и давлении углекислый газ находится в жидком и газообразном состоянии; при температуре и давлении, которые ниже этих показателей, газ, непосредственно минуя жидкую фазу, переходит в газообразное состояние (сублимирует).
В газообразном состоянии углекислый газ бесцветен, не имеет запаха и обладает слабовыраженным кислым вкусом. При температуре 0° С и атмосферном давлении плотность углекислого газа составляет 1,9769 кг/ж3; он в 1,529 раз тяжелее воздуха. При 0°С и атмосферном давлении 1 кг газа занимает объем 506 л. Связь между объемом, температурой и давлением углекислого газа выражается уравнением:
87. Опишите физические и химические свойства метана.
Химические свойства:
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 33,066 МДж на 1 м³. С воздухом образует взрывоопасные смеси при объёмных концентрациях от 4,4 % до 17 %. Точка замерзания −184oС (при нормальном давлении)
Вступает с галогенами в реакции замещения, которые проходят по свободно-радикальному механизму:

Выше 1400 °C разлагается по реакции:

Реакция горения метана:

Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
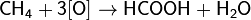
Физические:
Температура кипения метана -164,5°С
Температура плавления метана -182,5°С
Плотность метана по отношению к воздуху 0,554 (20°С)
Цвет метана отсутствует
Запах метана отсутствует
Температура воспламенения метана 650-750°С
88. Опишите физические и химические свойства окислов азота.
Мы уже знаем, что азот образует с кислородом не один а несколько окислов. Из них мы встречались с высшим окислом азота - пятиокисью азота N2О5, окисью азота NО и двуокисью азота NO2.
Окись азота NO - бесцветный газ.
Окись азота с водой не реагирует и очень мало растворима в ней
Окись азота не реагирует и с растворами кислот и щелочей - это не солеобразующий окисел.
Двуокись азота NO2 при обычных условиях - газ бурого цвета. Двуокись азота - ядовитый газ, и вдыхание ее вредно действует на сердце и на легкие. Она образуется при окислении окиси азота кислородом:
2NO + O2 2NO2 + Q
Реакция идет с выделением теплоты. Она обратима. При обычных условиях окись азота может полностью окислиться в двуокись азота, т. е равновесие смещено в сторону образования двуокиси азота. Равновесие смещается в обратную сторону при повышении температуры и понижении давления. При высоких температурах двуокись азота неустойчива, она разлагается неустойчива, она разлагается на окись азота и кислород. Реакция окисления окиси азота кислородом одна из немногих, скорость которой увеличивается не при повышении, а при понижении температуры.
В отличие от окиси азота, двуокись азота в воде растворима. Образующаяся в результате окисления окиси азота двуокись азота растворяется в воде с образованием бесцветного раствора.
Прибавив к нему синего лакмуса, мы установим, что образовалась кислота. При взаимодействии двуокиси азота с водой образуется азотная кислота HNO3:
3NО2 + H2O 2HNO3 + NO + Q
Двуокись азота - кислотный окисел.
Если проводить реакцию в присутствие кислорода, то выделяющаяся окись азота будет окисляться в двуокись азота и в конечном итоге получится только азотная кислота:
4NО2 + О2 + 2H2О 4HNО3 + Q
Эта реакция, как и предыдущая, экзотермическая и обратимая.
Двуокись азота - сильный окислитель. Уголь, сера, фосфор и другие вещества сгорают в ней. Двуокись азота сжижается под атмосферным давлением уже при температуре +21°C. Жидкая двуокись азота образует со многими органическими веществами взрывчатые смеси.
89. Опишите физические и химические свойства аммиака.
Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Плотность аммиака почти вдвое меньше, чем у воздуха, 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007. Растворимость NH3 в воде чрезвычайно велика
Хим-кие св-ва:
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
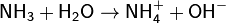
- . Взаимодействуя с кислотами, даёт соответствующие соли аммония:

- При нагревании аммиак разлагается, проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
 (реакция обратима)
(реакция обратима)
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
90. Какие физические и химические свойства водорода Вы знаете?
Водород — самый лёгкий газ. Водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде.Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии. Практически не растворим в серебре.
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
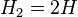 - 432 кДж
- 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:

Он может «отнимать» кислород от некоторых оксидов, например:

|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 742; Нарушение авторских прав?; Мы поможем в написании вашей работы!