
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пакет экзаменатора №28
|
|
|
|
Условия выполнения задания:
Задание №1. Ответить на поставленный вопрос.
№ 21 – Sc скандий, 4 период, III группа, побочная подгруппа, 21 протон, 21 электрон, 45-21 = 24 нейтрона
Э.ф. 1s22s22p63s23p64s23d1
№ 32 – Ge германий, 4 период, IV группа, главная подгруппа, элемент проявляющий амфотерные свойства, 32 протона, 32 электрона, 72-32 = 40 нейтронов
Э.ф. 1s22s22p63s23p64s23d104p2
№ 38 – Sr стронций, 5 период, II группа, главная подгруппа, 38 протонов, 38 электронов, 88-38 = 50 нейтронов
Э.ф. 1s22s22p63s23p64s23d104p65s2
Задание №2. Дать характеристику положения элементов № 29, 33, 39 в Периодической системе Д.И. Менделеева. Написать их электронные формулы и структуры атомов.
Задание №2. Дать характеристику положения элементов № 29, 33, 39 в Периодической системе Д.И. Менделеева. Написать их электронные формулы и структуры атомов.
№ 29 – Cu медь, 4 период, I группа, побочная подгруппа, 29 протонов, 29 электронов, 63-29 = 34 нейтрона
Э.ф. 1s22s22p63s23p64s13d10
№ 33 – As мышьяк, 4 период, V группа, главная подгруппа, 33 протона, 33 электрона, 75-33 = 42 нейтрона
Э.ф. 1s22s22p63s23p64s23d104p3
№ 39 – Y иттрий, 5 период, III группа, побочная подгруппа, 39 протонов, 39 электронов, 89-39 = 50 нейтронов
Э.ф. 1s22s22p63s23p64s23d104p65s24d1
Задание №2. Дать характеристику положения элементов № 21, 32, 38 в Периодической системе Д.И. Менделеева. Написать их электронные формулы и структуры атомов.
Задание №2. Дать характеристику положения элементов № 21, 32, 38 в Периодической системе Д.И. Менделеева. Написать их электронные формулы и структуры атомов.
№ 21 – Sc скандий, 4 период, III группа, побочная подгруппа, 21 протон, 21 электрон, 45-21 = 24 нейтрона
Э.ф. 1s22s22p63s23p64s23d1
№ 32 – Ge германий, 4 период, IV группа, главная подгруппа, элемент проявляющий амфотерные свойства, 32 протона, 32 электрона, 72-32 = 40 нейтронов
|
|
|
Э.ф. 1s22s22p63s23p64s23d104p2
№ 38 – Sr стронций, 5 период, II группа, главная подгруппа, 38 протонов, 38 электронов, 88-38 = 50 нейтронов
Э.ф. 1s22s22p63s23p64s23d104p65s2
Задание №1. Химические свойства оснований.
Условия выполнения задания:
Задание №1. Ответить на поставленный вопрос.
Химические свойства оснований.
| Щёлочи | Нерастворимые основания |
| 1.Взаимодействие с кислотами | |
| KOH+HCl=KCl+H2O | Cu(OH)2+2HCl=CuCl2+2H2O |
| 2.Взаимодействие с кислотными оксидами | |
| 2KOH+CO2=K2CO3+H2O | не характерны |
| 3.Действие индикаторов | |
| лакмус-синяя, фенолфталеин-малиновая | окраска не изменяется |
| 4.Взаимодействие с амфотерными оксидами | |
| 2KOH+ZnO=K2ZnO2+H2O | не реагируют |
| 5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание | |
| NaOH+CuCl2=Cu(OH)2=2NaCl | не реагируют |
| 6.При нагревании | |
| не разлагаются(кроме LiOH) | Cu(OH)2=CuO+H2O |
| Амфотерные гидроксиды(Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие. | |
| Взаимодействуют с кислотами Zn(OH)2+2HCl=ZnCl2+2H2O | Взаимодействуют с щелочами Al(OH)3+NaOH=Na[Al(OH)4] |
Задание №1. Классификация неорганических соединений. Основные представители оксидов.
Задание №1. Ответить на поставленный вопрос.
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Называются они просто - "оксид + название элемента"(см. ниже).Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента. Классификация оксидов.

Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами-ОН. Общая формула:

По номенклатуре основания называют гидроксидами:
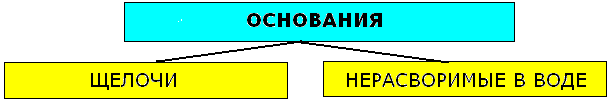
К щелочам относят гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Остальные - нерастворимые. К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью - как кислоты.
|
|
|
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Число атомов водорода определяет основность кислот.
| Формула кислоты | Название |
| HCl | хлороводородная, или соляная кислота |
| HF | фтороводородная, или плавиковая кислота |
Классификация кислот.
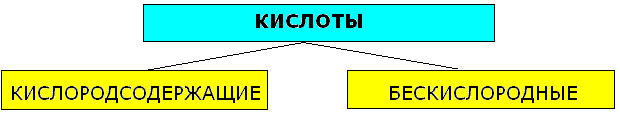
| HNO2, HNO3, H2SO3, H2SO4, H2CO3, H2SiO3, H3PO4 | HCl, HF, HI, H2S |
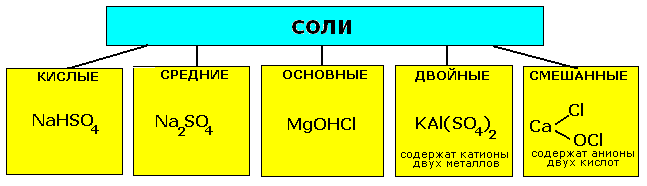
Соли - сложные вещества, состоящие из атомов металлов металлов (иногда входит водород) и кислотных остатков.
Классификация солей.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 228; Нарушение авторских прав?; Мы поможем в написании вашей работы!