
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. 1. Разбавленная азотная кислота проявляет все свойства кислот
|
|
|
|
1. Разбавленная азотная кислота проявляет все свойства кислот. Она относится к сильным кислотам. В водных растворах диссоциирует:
Н++NO-3 Под действием теплоты и на свету частично разлагается:«HNO3
4HNO3=4NO2+2Н2O+O2 Поэтому хранят ее в прохладном и темном месте.
2. Для азотной кислоты характерны исключительно окислительные свойства. Важнейшим химическим свойством является взаимодействие почти со всеми металлами. Водород при этом никогда не выделяется. Восстановление азотной кислоты зависит от ее концентрации и природы восстановителя. Степень окисления азота в продуктах восстановления находится в интервале от +4 до -3:
N-3H4NO3®N02®N+12O®N+2O®HN+3O2 ®N+4O2®HN+5O3
Продукты восстановления при взаимодействии азотной кислоты разной концентрации с металлами разной активности приведены ниже в схеме.

Концентрированная азотная кислота при обычной температуре не взаимодействует с алюминием, хромом, железом. Она переводит их в пассивное состояние. На поверхности образуется пленка оксидов, которая непроницаема для концентрированной кислоты.
Примеры:
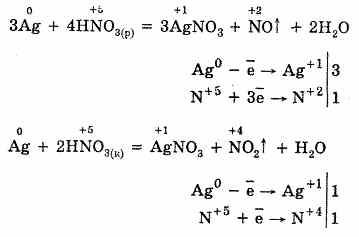
3. Азотная кислота не реагирует с Pt, Rh, Ir, Та, Au. Платина и золото растворяются в «царской водке» — смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты:
+2Н2О НСl+AuСl3=H[AuCl4]Au+НNO3+3НСl= AuСl3+NO
+8H2O 2HCl+PtCl4=H2[PtCl6]3Pt+4HNO3+12НСl=3PtCl4+4NO
Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора:
HNO3+HCl=Сl2+2Н2О+NOCl 2NOCl=2NO+Сl2 Выделяющийся хлор соединяется с металлами.
4. Неметаллы окисляются азотной кислотой до соответствующих кислот, а она в зависимости от концентрации восстанавливается до NO или NO2:
+4Н2О 3Р+5HNO3(pазб)+2Н2О= 3Н3РО4+5NO+Н2О I2+10HNO3(конц)=2HIO3+10NO2+2Н2ОР+5НNO3(конц)=Н3РO4+5NO2S+бНNO3(конц)=H2SO4+6NO2
5. Она также взаимодействует с органическими соединениями.
Соли азотной кислоты называются нитратами, представляют собой кристаллические вещества, хорошо растворимые в воде. Их получают при действии HNO3 на металлы, их оксиды и гидрокси-ды. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры используются главным образом как минеральные азотные удобрения. Кроме того, KNO3 применяют для приготовления черного пороха (смесь 75% KNO3, 15% С и 10% S). Из NH4NO3, порошка алюминия и тринитротолуола изготавливают взрывчатое вещество аммонал.
Соли азотной кислоты при нагревании разлагаются, причем продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:
|
|
|

Разложение при нагревании (термолиз) — важное свойство солей азотной кислоты.
2KNO3=2KNO2+O2
+O22Cu(NO3)2=2CuO+NO2
Соли металлов, расположенных в ряду левее Mg, образуют нитриты и кислород, от Mg до Cu — оксид металла, NO2 и кислород, после Си — свободный металл, NO2 и кислород.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 2967; Нарушение авторских прав?; Мы поможем в написании вашей работы!